Det kemiska grundämnet lantan klassas som en lantanid och sällsynt jordartsmetall. Det upptäcktes 1839 av Carl G. Mosander.

Datazon
| Klassificering: | Lantan är en lantanid och sällsynt jordartsmetall |
| Färg: | silvervitt |
| Atomic vikt: | 138.9055 |
| Tillstånd: | solid |
| Smältpunkt : | 1540 oC, 1813,2 K |
| Kokpunkt: | 2830 oC, 3103 K |
| Elektroner: | 57 |
| Protoner: | 57 |
| Neutroner i vanligast isotop: | 82 |
| Elektronskal: | 2,8,18,18, 9,2 |
| Elektronkonfiguration: | 5d1 6s2 |
| Densitet @ 20oC: | 6,16 g / cm3 |
Visa mer, inklusive: Värmer, Energier, Oxidation,
Reaktioner , Föreningar, radier, konduktiviteter
| Atomvolym: | 22,5 cm3 / mol |
| Struktur: | hcp: sexkantig nära packad |
| Hårdhet: | 2,5 mohs |
| Specifik värmekapacitet | 0,19 J g-1 K-1 |
| Fusionsvärme | 6,20 kJ mol-1 |
| Förstörningsvärme | 414 kJ mol-1 |
| Värme av förångning | 400 kJ mol-1 |
| första joniseringsenergi | 538,1 kJ mol-1 |
| 2: a joniseringsenergin | 1067 kJ mol-1 |
| 3: e joniseringsenergi | 1850 kJ mol-1 |
| Elektronaffinitet | 50 kJ mol-1 |
| Lägsta oxidationsnummer | 0 |
| Min. gemensamt oxidationsnummer. | 0 |
| Maximalt oxidationsnummer | 3 |
| Max. vanlig oxidation nr. | 3 |
| Elektronegativitet (Pauling Scale) | 1.1 |
| polariserbarhet volym | 31.1 Å3 |
| Reaktion med luft | kraftfull, w / ht ⇒ La2O3 |
| Reaktion med 15 M HNO3 | mild, ⇒ La (NO3) 3 |
| Reaktion med 6 M HCl | mild, ⇒ H2, LaCl3 |
| Reaktion med 6 M NaOH | ingen |
| Oxid ( s) | La2O3 |
| Hydrid (er) | LaH2, LaH3 |
| Klorid (er) | LaCl3 |
| Atomradie | 195 pm |
| Jonisk radie (1+ jon) | – |
| Jonisk radie (2+ jon) | – |
| Jonisk radie (3+ jon) | 117.2 pm |
| Jonisk radie (1- jon) | – |
| Jonisk radie (2- jon) | – |
| Jonisk radie (3-jon) | – |
| Värmeledningsförmåga | 13,4 W m-1 K-1 |
| Elektrisk ledningsförmåga | 1,9 x 106 S m-1 |
| Frys- / smältpunkt: | 1540 oC, 1813,2 K |

Lantan används i många applikationer, såsom studiobelysning, laptopbatterier, kameralinser och hybridbatterier.
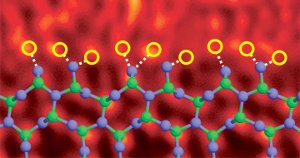
Silikonitridkorngräns dopad med lantanatomer. Bild Ref. (6)
Upptäckt av lantan
Lanthanum upptäcktes 1839 av Carl G. Mosander i mineralet cerit i Stockholm, Sverige.
Ceria (ceriumoxid) hade redan upptäckts 1803 av den svenska kemisten Jacob Berzelius i mineral cerit. Mosander, som hade varit en av Berzelius studenter, misstänkte att ceria var en oren oxid som innehöll andra sällsynta jordarter. (1)
Mosander tog fint pulveriserat ceriumnitrat och tillsatte kall utspädd salpetersyra. En del av ceriumnitratpulvret upplöst i syran som indikerar en ny jord kan vara närvarande. Den nya oxiden var mer basisk än ceriumoxid (ceriumoxid) och, till skillnad från ceriumoxid, upplöst i syran.
Mosander separerade lösningen från fällningen med natriumoxalat och värme. Han fick en blek tegelfärgad oxid av den nya sällsynta jorden. (1)
Namnet lanthana för den nya oxiden föreslogs av hans vän Berzelius.
Namnet kommer från det grekiska ordet ”lanthano” som betyder att det ska döljas.
Axel Erdmann upptäckte lanthanum självständigt samma år som Mosander i ett nyligen hittat norskt mineral. Erdmann kallade det nya mineralet mosandrit för att hedra Mosander.(2)
Mosander erhöll oren metallisk lantan från kloriden. (1)
Ren lantanmetall producerades först 1923 genom elektrolys av de smälta haliderna av H. Kremers och R. Stevens.
Mosander fortsatte att studera lanthana och 1841 meddelade upptäckten av en annan sällsynt jord som finns i den. Han kallade det ”didymium” eftersom det verkade vara ”en oskiljaktig tvillingbror till lantan.” (2)
”Didymium” visades senare i separata upptäckter som en blandning av okända sällsynta jordartsmetaller. År 1879 upptäckte Lecoq de Boisbaudran samarium i didymium och separerade samarium från det. Carl Auer von Welsbach upptäckte 1885 att det återstående ”didymium” egentligen var en blandning av två helt nya element: neodymium och praseodymium.


Lantan används i vissa poolprodukter för att minska nivån av fosfatnäringsämnen som matas alger.

Medurs från övre centrum: Sällsynta jordoxider av praseodym, cerium, lantan, neodym, samarium och gadolinium. Foto: LLNL
Utseende och egenskaper
Skadliga effekter:
Lantan och dess föreningar anses vara måttligt giftiga.
Egenskaper:
Lantan är en silvervit mjuk metall som kan skäras med en kniv.
Den är segbar , smidiga och exponerade ytor suddas snabbt i luft som bildar oxiden.
Lantan reagerar med vatten för att bilda lantanhydroxid plus vätgas.
Lantan är kemiskt reaktivt och bildar föreningar med kol, kväve , bor, selen, kisel, fosfor, svavel och med halogenerna.
Lantan existerar vanligtvis som en trivalent jon, La3 +, i dess föreningar.
Användning av lantan
Lantan används i stora mängder i uppladdningsbara NiMH-batterier (nickelmetallhydrid) för hybridbilar. Den negativa elektroden (katoden) i NiMH-batterier är en blandning av metallhydrider – varav en typiskt är lantanhydrid. Det aktiva materialet vid katoden är väte, som lagras i metallhydridstrukturen. Metallhydrid kan, beroende på dess sammansättning, innehålla mellan 1 och 7 vikt-% väte. (3) Ett Toyota Prius-batteri kräver cirka 10 kg lantan. (4)
Lantan används som en petroleumkrackningskatalysator, vilket katalyserar uppdelningen av långkedjiga kolväten till kortare kedjearter.
Lantan används som tillsats för att göra nodulärt gjutjärn och som tillsats i stål.
Flammare med flammor använder mischmetall (en sällsynt jordlegering) som innehåller lantan för att producera gnistor genom friktion.
Lanthan används i vätesvamplegeringar, som tar upp till 400 gånger sin egen volym vätgas.
Lantan används också för att göra glasögon (infrarödabsorberande glas).
Kamera- och teleskoplinser av hög kvalitet innehåller lantanoxid (La2O3) som använder dess höga brytningsindex och låga dispersion.
Lantankarbonat används för att minska blodnivåerna av fosfat hos patienter med njursjukdom. (5)
Lantanföreningar används också i vissa poolprodukter för att minska nivån av fosfatnäringsämnen som alger matar på.
Överflöd och isotoper
Överflöd av jordskorpa: 34 viktdelar per miljon, 5 delar per miljon mol
Överflöd solsystem: 2 delar per miljard med vikt, 0,01 delar per miljard mol
Kostnad, ren: $ 800 per 100 g
Kostnad, bulk: $ per 100 g
Källa: Lantan hittades inte gratis i naturen. Det finns främst i mineralerna monazit och bastnaesit. Kommersiellt utvinns den från monazitsand och bastnaesit med användning av olika komplexa extraktionstekniker. Rent lantan erhålls genom reduktion av fluor med kalciummetall.
Isotoper: Lantan har 31 isotoper vars halveringstid är känd, med massnummer 119 till 150. Av dessa är en stabil, 139La. Naturligt förekommande lantan är en blandning av de två isotoperna 138La och 139La med naturliga överflöd på 0,09% respektive 99,91%.

Citera den här sidan
För att länka online, vänligen kopiera och klistra in något av följande:
<a href="https://www.chemicool.com/elements/lanthanum.html">Lanthanum</a>
eller
<a href="https://www.chemicool.com/elements/lanthanum.html">Lanthanum Element Facts</a>
För att citera den här sidan i ett akademiskt dokument, använd följande MLA-kompatibla citat:
"Lanthanum." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/lanthanum.html>.