Introdução
Bocejar é uma sequência involuntária de abertura da boca, inspiração profunda, apnéia breve e expiração mais ou menos lenta (Baenninger, 1997; Walusinski e Deputte, 2004; Guggisberg et al., 2010; Krestel et al., 2018). Quando provocado, um bocejo não pode ser totalmente suprimido. Portanto, foi definido como um padrão estereotipado ou semelhante a reflexo (Lehmann, 1979; Provine, 1986). No Homo sapiens, várias hipóteses foram levantadas com suporte variável para explicar os mecanismos e funções do bocejo espontâneo, como oxigenação (função respiratória causada pela hipóxia), comportamento relacionado ao estresse (causado pela excitação) ou termorregulação (causada pela hipertermia; Guggisberg et al., 2010; Massen et al., 2014; Gallup e Gallup, 2019). Por ser uma resposta fisiológica, o bocejo pode ser afetado por fatores internos e externos, como a hora do dia (Giganti e Zilli, 2011) ou temperatura intracraniana / cerebral (Gallup e Eldakar, 2013).
O bocejo pode ser autodirigido e / ou exibido para outros (Moyaho et al., 2017; Palagi et al., 2019) Em primatas humanos e não humanos, dependendo da espécie, quando o bocejo é mostrado aos outros, ele pode comunicar ameaça (Troisi et al., 1990; Deputte, 1994) e / ou alterações fisiológicas e comportamentais (Provine et al., 1987 ; Leone et al., 2015; Zannella et al., 2015). Em humanos, o bocejo é uma resposta modulada socialmente porque pode ser inibido pela presença social real – e não virtual (Gallup et al., 2019) e porque um bocejo pode ser desencadeado pelo bocejo de outra pessoa, como resultado de um fenômeno conhecido como bocejo contagioso (Provine, 1989, 2005). O contágio do bocejo pode ser provocado mesmo que o bocejo seja ouvido, mas não visto (Arnott et al., 2009; Massen et al., 2015).
Em humanos, suas espécies de macacos filogeneticamente mais próximas (chimpanzés: Pan paniscus ; bonobos: Pan troglodytes) e o macaco africano Theropithecus gelada, o bocejo contagioso não está apenas presente (Provine, 1986; Palagi et al., 2009; Tan et al., 2017; mas veja: Amici et al., 2014), mas também modulada socialmente porque a resposta ao bocejo é mais alta quando certas categorias de indivíduos estão envolvidas (por exemplo, parentes, membros do grupo, dominantes; Palagi et al., 2009; Campbell e de Waal, 2011, 2014; Norscia e Palagi, 2011; Demuru e Palagi, 2012; Massen et al., 2012). Dois argumentos principais foram apresentados para explicar essa assimetria social no bocejo contagioso, os quais foram agrupados em duas hipóteses principais: a Hipótese de Viés Emocional (EBH), ligando o bocejo contagioso à transferência emocional, e a Hipótese de Viés de Atenção (ABH), que considera bocejo contagioso como uma resposta motora que está sujeita a diferenças nos processos de atenção de cima para baixo (Palagi et al., 2020).
O EBH prevê que a assimetria social observada nas taxas de contágio do bocejo reflete diferenças nas diferentes vínculo social, um proxy de vínculo emocional, entre os indivíduos. Esta hipótese é apoiada por evidências de que as taxas de contágio de bocejo seguem uma tendência empática (sensu Preston e de Waal, 2002), sendo mais altas entre indivíduos que compartilham um vínculo emocional mais forte. Especificamente, Norscia e Palagi (2011) descobriram que em humanos as taxas de contágio do bocejo são maiores em resposta a parentes e amigos do que em resposta a conhecidos e estranhos. Em chimpanzés adultos, o contágio do bocejo é maior entre os membros do grupo em comparação com os membros do grupo externo (Campbell e de Waal, 2011) e nos bonobos as taxas de contágio do bocejo são maiores entre os indivíduos que se afiliam mais (Demuru e Palagi, 2012). Em uma investigação comparativa incluindo humanos e bonobos, Palagi et al. (2014) descobriram que as taxas de contágio do bocejo foram afetadas pela qualidade do relacionamento entre os indivíduos mais do que pelas espécies a que os indivíduos pertenciam. Além disso, em humanos, o contágio do bocejo aumenta com a idade quando a capacidade de identificar as emoções dos outros aumenta e diminui com a idade quando essa capacidade diminui (Wiggers e van Lieshout, 1985; Anderson e Meno, 2003; Saxe et al., 2004; Singer, 2006; Millen e Anderson, 2011; Bartholomew e Cirulli, 2014). As taxas de contágio de bocejo aumentam da infância à idade adulta também em chimpanzés (Madsen e Persson, 2013).
O ABH prevê que a assimetria social observada no contágio de bocejo pode ser devido a diferenças na atenção social e visual (Massen e Gallup, 2017). Em particular, os níveis mais altos de bocejos contagiosos seriam devido à atenção visual seletiva extra de cima para baixo dada a indivíduos que são mais relevantes para o observador, como assuntos familiares, como ocorre em humanos e geladas, ou dominantes, como ocorre em chimpanzés ou bonobos (Yoon e Tennie, 2010; Massen et al., 2012; Massen e Gallup, 2017).De acordo com Massen e Gallup (2017), a ABH seria apoiada pelas evidências existentes sobre a detecção visual diferente e codificação perceptível visual de rostos de assuntos familiares e / ou em grupo em comparação com os desconhecidos (por exemplo, Buttle e Raymond, 2003 ; Ganel e Goshen-Gottstein, 2004; Jackson e Raymond, 2006; Michel et al., 2006).
Neste estudo, analisamos dados sobre bocejos coletados ao longo de 9 anos em humanos em seus ambientes naturais e extrapolamos os casos em que o bocejo emitido por um sujeito podia ser ouvido, mas não visto por um potencial respondente (bocejo auditivo). Ao considerar apenas os casos em que a pista visual do estímulo de bocejo não foi detectável, verificamos se a assimetria social observada anteriormente nas taxas de contágio de bocejo persistia ou não. Em particular, testamos as seguintes previsões alternativas derivadas das duas hipóteses apresentadas acima (EBH e ABH).
Previsão 1a: de acordo com a EBH, as taxas de contágio do bocejo são influenciadas pela força do inter – vínculo social individual – um proxy do vínculo emocional – per se e não por uma atenção visual seletiva e de cima para baixo dada a certos indivíduos em particular. Se esta hipótese for apoiada, esperamos observar o preconceito social também quando a pista visual do estímulo de bocejo é excluída e as taxas de bocejo contagioso auditivo sejam mais altas entre indivíduos fortemente ligados em comparação com indivíduos fracamente ligados.
Previsão 1b: de acordo com a ABH, os níveis mais elevados de contágio de bocejo entre indivíduos fortemente ligados em comparação com indivíduos fracamente ligados estariam ligados à atenção visual seletiva de cima para baixo mais próxima que os indivíduos prestam aos indivíduos que são relevantes para eles, por exemplo, família amigos. Se esta hipótese for apoiada, o preconceito social observado no contágio do bocejo deve desaparecer quando apenas bocejos auditivos são considerados, porque a dica visual não pode ser atendida pelo respondente potencial.
Materiais e métodos
Coleta de dados e definições operacionais
Para este estudo, consideramos os bocejos vocalizados emitidos por um sujeito que só podia ser ouvido – mas não visto – por um respondente potencial (doravante: bocejos auditivos). O emissor e os respondentes potenciais deveriam estar em uma faixa de ≤5 m. Os bocejos vocalizados envolviam o uso de pregas vocais e os bocejos que envolviam apenas inspiração / expiração pesada não foram considerados vocalizados; 294 casos de bocejos auditivos foram extrapolados de um conjunto de dados de um total de 2001 episódios de bocejo coletados ao longo de 9 anos – de 2010 a 2019 – usando o método de amostragem de todas as ocorrências (Altmann, 1974). Especificamente, os bocejos auditivos foram coletados de novembro de 2010 a maio de 2019, das 05h30 às 02h30, em indivíduos humanos caucasianos, com idade entre 18 e 77 anos, durante suas atividades rotineiras, por exemplo, em locais de trabalho, durante as refeições, durante reuniões sociais, etc. ., com os sujeitos inconscientes de serem observados e na ausência de qualquer fonte externa evidente de ansiedade. O banco de dados de bocejos auditivos incluiu 193 díades respondentes com potencial para bocejos. Dependendo da situação, as informações eram registradas, não anotadas, por meio de códigos alfanuméricos e lançadas diretamente em planilhas de cálculo, digitadas no celular ou escritas em papel, e posteriormente lançadas em planilhas de cálculo para posterior elaboração. Informações básicas como idade e relacionamento entre as pessoas eram conhecidas dos autores. Os respondentes potenciais foram codificados como na condição de ausência de visão quando sua cabeça foi girada 180 ° em relação ao gatilho ou quando um obstáculo de bloqueio de visão físico estava presente impedindo o respondente potencial de ver o rosto e o corpo do gatilho. O gatilho e o respondedor nunca foram completamente isolados (por exemplo, em duas salas separadas com portas fechadas) um do outro. A proximidade social foi coletada em quatro níveis: 0 = estranhos, que nunca haviam se encontrado antes; 1 = conhecidos, que compartilhavam exclusivamente uma relação indireta baseada em um terceiro elemento externo, que é o dever de trabalho (colegas) ou amigos em comum (amigos de amigos); 2 = amigos, indivíduos não relacionados que compartilham um relacionamento direto não relacionado exclusivamente com um terceiro elemento externo; 3 = parceiros regulares e parentes (r ≥ 0,25). A literatura anterior relata que as respostas do bocejo podem ser obtidas dentro de 5 minutos após assistir ao bocejo de outra pessoa (o bocejo do gatilho) (Provine, 1986), com um máximo no primeiro minuto (Provine, 2005; Palagi et al., 2014). A literatura também relata que a partir do quarto minuto há uma maior probabilidade de autocorrelação (o que significa que a presença de um bocejo realizado por um sujeito em t0 aumenta a probabilidade de ter outro bocejo do mesmo sujeito em t (0 + X) onde X é a unidade crescente de tempo; Kapitány e Nielsen, 2017). Portanto, consideramos as respostas de bocejo que ocorrem dentro de uma janela de tempo de 3 minutos a partir do bocejo emitido pelo gatilho.Para reduzir ainda mais o viés de autocorrelação, no caso de uma cadeia de bocejos emitidos pelo gatilho (mais bocejos emitidos na janela de tempo de 3 minutos) registramos como resposta apenas o primeiro bocejo realizado após a percepção do último bocejo. Codificamos um bocejo como “espontâneo” quando nenhum outro sujeito havia bocejado nos 5 minutos anteriores ao evento de bocejo.
Análises estatísticas
Para as análises, as seguintes variáveis foram consideradas: ocorrência de contágio, codificado como: 1 = presença, 0 = ausência; o vínculo social foi inserido com os quatro níveis definidos acima (0 = estranhos; 1 = conhecidos; 2 = amigos; 3 = parentes); sexo do gatilho e do observador foram rotulados como : M = masculino, F = feminino; as classes de idade do acionador e do respondente foram codificadas da seguinte forma: yo = jovem (18–24 anos); ad = adulto (25–64 anos); se = sênior (acima 65 anos) (Statistics Canada, 2009); os intervalos de tempo foram codificados da seguinte forma: 1 = 05: 30–09: 00; 2 = 09:01 – 12:30; 3 = 12: 31–16: 00h00; 4 = 16: 01–19: 30; 5 = 19: 31–23: 00h; 6 = 23: 01–02: 30 (Giganti e Zilli, 2011). O banco de dados (consulte a folha de dados suplementar) incluiu 84 homens, 69 mulheres, 16 jovens (yo), 122 adultos (ad) e 15 idosos (se). Para testar se a ocorrência de bocejo o contágio foi influenciado pelos fatores vínculo (0 = desconhecidos; 1 = conhecidos; 2 = amigos; 3 = parentesco), sexo do acionador (Trigger_sex), sexo do respondente (Responder_sex), a classe de idade do acionador (Trigger_ageclass) e a classe de idade do respondente (Responder_ageclass) e intervalo de tempo (de 1 a 6 ), usamos um modelo linear generalizado misto (GLMM) que incluiu esses cinco preditores como efeitos fixos e gatilhos (Trigger) e identidades dos respondentes (Responder) como efeitos aleatórios. Ajustamos os modelos em R (R Core Team, 2018; versão 3.5.1) usando a função lmer do pacote R lme4 (Bates et al., 2015). Estabelecemos a significância do modelo completo em comparação com um modelo nulo compreendendo apenas os efeitos aleatórios (Forstmeier e Schielzeth, 2011). Usamos um teste de razão de verossimilhança (Dobson, 2002) para testar essa significância (ANOVA com o argumento “Chisq”). Calculamos os valores de p para os preditores individuais com base em testes de razão de verossimilhança entre o modelo completo e o modelo nulo usando o R -função “drop1” (Barr et al., 2013). Como a variável de resposta era binária, usamos uma distribuição de erro binomial. Testamos se a interação entre os sexos ou as classes de idade do gatilho e do respondente eram significativas, mas como não eram, não os incluímos no modelo. Usamos um pacote de contraste múltiplo (multcomp) para realizar todas as comparações de pares para cada nível de colagem com o teste de Tukey (Bretz et al., 2010). Nós relatamos os valores p ajustados de Bonferroni, estimativa (Est), erro padrão (SE) e valores z.
Resultados

Figura 1. Gráfico de linha do efeito do vínculo social entre o gatilho e o respondedor (eixo X) na ocorrência média de contágio acústico de bocejo (eixo Y). Amigos e parentes apresentam frequências de contágio de bocejo significativamente mais altas do que estranhos e conhecidos (teste de Tukey: amigos versus estranhos p < 0,001; parentes contra estranhos p < 0,001; amigos versus conhecidos p < 0,001; parentes versus conhecidos p < 0,001; outras combinações, ns).
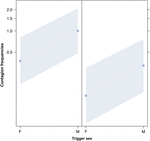
Figura 2. Gráfico de linha de o efeito do sexo do gatilho (eixo X) na ocorrência média de contágio acústico de bocejo (eixo Y). Efeito do sexo desencadeante no contágio acústico do bocejo quando o respondente é uma mulher (direita) e um homem (esquerda). Os bocejos dos homens provocam mais bocejos do que os das mulheres, independentemente do sexo do respondente (resultado do GLMM, p = 0,022). Os pontos representam o efeito que a variável de resposta tem sobre a variável independente “sexo do gatilho”, com base no valor previsto pelo modelo. As faixas coloridas mostram o intervalo de confiança de 95%.
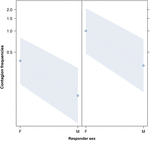
Figura 3. Gráfico de linha do efeito do sexo do respondedor (eixo X) na ocorrência média de contágio acústico de bocejo (eixo Y). Efeito do sexo respondedor no contágio acústico de bocejo quando o gatilho é uma mulher (direita) ou um homem (esquerda). As mulheres respondem significativamente mais do que os homens, independentemente do sexo do gatilho (resultado do GLMM, p = 0,021). Os pontos representam o efeito que a variável de resposta tem na variável independente “sexo do respondente”, com base no valor predito pelo modelo. As bandas coloridas mostram o intervalo de confiança de 95%.
Discussão
Este estudo mostra pela primeira vez que o contágio do bocejo é significativamente afetado pelo laço social entre os indivíduos (Tabela 1) mesmo quando os estímulos desencadeadores são bocejos auditivos, que definimos como bocejos vocalizados que podiam ser ouvidos, mas não vistos (pista visual indetectável, pista auditiva detectável). Em particular, o bocejo contagioso auditivo é significativamente mais frequente entre parentes e amigos do que entre estranhos e conhecidos (Figura 1). Este achado suporta a previsão 1a com base no EBH e não a previsão 1b com base no ABH, levando à conclusão de que, em humanos, a atenção visual seletiva de cima para baixo não pode ser o principal impulsionador da assimetria social observada nas taxas de contágio de bocejo (Norscia e Palagi , 2011; Norscia et al., 2016a). Além disso, o sexo do gatilho e o sexo do receptor tiveram um efeito significativo nas taxas de contágio de bocejo, com os homens – como gatilhos – sendo respondidos por outras pessoas com mais frequência do que as mulheres (Figura 2) e as mulheres respondendo com mais frequência aos bocejos dos outros do que homens (Figura 3).
Ao contrário de Bartholomew e Cirulli (2014), não encontramos efeito da idade no contágio do bocejo, muito provavelmente porque nosso banco de dados sobre bocejos auditivos teve uma forte prevalência de adultos (25-64 anos velho). Os níveis mais altos de contágio auditivo do bocejo em mulheres em comparação com os homens confirmam o viés de gênero observado em condições naturalísticas em humanos suscetíveis ao contágio de bocejo por Norscia et al. (2016a, b) ao considerar um conjunto de dados maior que também incluiu bocejos que poderiam ser vistos pelo respondente potencial (com a modalidade sensorial do bocejo – visão, audição ou ambos – não afetando a resposta). O viés de gênero também está parcialmente de acordo com os resultados anteriores obtidos em ambientes controlados, incluindo a dica visual (Chan e Tseng, 2017; mas ver Norscia e Palagi, 2011; Bartholomew e Cirulli, 2014). Foi levantada a hipótese de que o alto grau de contágio de bocejo em mulheres pode informar o contágio emocional (Norscia et al., 2016a), à luz de habilidades empáticas relatadas – relacionadas à maternidade – de mulheres em comparação com os homens (Christov-Moore et al. ., 2014). No entanto, essa questão ainda está em debate porque as diferenças culturais entre as sociedades humanas podem moldar a dinâmica dos laços sociais de uma maneira diferente. Portanto, é complicado, neste estágio do conhecimento, separar os fatores culturais, a qualidade do relacionamento interpessoal e a influência do gênero na distribuição do contágio do bocejo. Nossos resultados também mostram que os homens têm um desempenho melhor do que as mulheres como gatilhos e a hipótese mais parcimoniosa para isso pode ser que as vocalizações dos homens podem ser melhor ouvidas em ambientes naturais, muitas vezes caracterizados por ruídos de fundo. De fato, a percepção do gênero da voz depende principalmente da frequência fundamental que é em média uma oitava mais baixa em vozes masculinas do que femininas, com vocalizações de frequência mais baixas indo além das de alta frequência (Marten e Marler, 1977; Latinus e Taylor, 2012) . No entanto, até onde sabemos, não há nenhum estudo específico abordando o possível viés de gênero na audibilidade do bocejo e, portanto, uma investigação mais aprofundada com ensaios experimentais em condição controlada é necessária para verificar essa especulação.
Neste estudo, também encontramos que as diferenças nas taxas de contágio de bocejo entre as categorias (família e amigos, estranhos e conhecidos) não podem ser explicadas por diferenças na atenção visual seletiva de cima para baixo. Este achado está de acordo com a literatura anterior. O bocejo contagioso parece envolver áreas do cérebro que estão mais relacionadas à rede de orientação de baixo para cima do que áreas relacionadas de cima para baixo. Além disso, o contágio do bocejo não é sensível às pistas sensoriais presentes no sinal (auditivo, visual ou audiovisual) (Arnott et al., 2009; Norscia e Palagi, 2011) nem afetado pela perspectiva visual do estímulo desencadeador ( bocejos nas orientações de 90 °, 180 ° e 270 ° são capazes de desencadear respostas de bocejo como bocejos frontais, 0 °; Provine, 1989, 1996). Chan e Tseng (2017) descobriram que a capacidade de detectar um bocejo como tal (sensibilidade de detecção perceptual) estava relacionada à duração do olhar para os olhos do rosto de liberação de estímulo, mas os padrões de olhar fixo não foram capazes de modular o bocejo contagioso. Em chimpanzés, as frequências de bocejos contagiosos eram mais altas entre o mesmo grupo do que entre indivíduos de grupos diferentes, mesmo que os respondentes olhassem por mais tempo para vídeos de chimpanzés de fora do grupo (Campbell e de Waal, 2011). O argumento de que a atenção seletiva visual pode distorcer as taxas de contágio do bocejo em uma direção específica (sujeitos respondendo mais à família do que a estranhos) também é prejudicado pela ausência de qualquer padrão específico de atenção social em primatas humanos e não humanos. Por meio do rastreamento ocular (aplicado para medir o tempo de visualização) e mostrando rostos desconhecidos para seus sujeitos experimentais, Méary et al.(2014) observaram que os humanos eram inclinados para rostos de sua própria raça, enquanto a atenção dos macacos rhesus era mais atraída por rostos novos do que por rostos da mesma espécie. Kawakami et al. (2014) observaram que os sujeitos humanos prestavam mais atenção aos olhos dos membros do grupo étnico e ao nariz e boca dos membros do grupo étnico. O mesmo estudo também revelou que a atenção visual não depende da raça alvo. Ao medir por quanto tempo os sujeitos experimentais olharam para a tela, Whitehouse et al. (2016) observaram que os macacos berberes prestavam mais atenção aos vídeos de arranhões de não estranhos do que de indivíduos estranhos, mas também observaram que, entre os não estranhos, os macacos prestavam mais atenção àqueles indivíduos com os quais compartilhavam uma ligação social fraca. Ao medir as taxas de relance, Schino e Sciarretta (2016) observaram que os mandril olhavam mais para seus próprios parentes do que para não-parentes, mas também mais para os dominantes do que para os companheiros de grupo subordinados. Portanto, esses estudos (usados para apoiar a ABH) não descrevem um padrão único de atenção seletiva. Outro ponto importante a ser considerado é a própria definição de familiaridade e associação ao grupo adotada pela maioria dos estudos usados para apoiar a ABH (Massen e Gallup, 2017). Esses estudos mostraram uma melhor detecção visual e codificação perceptiva visual de rostos de sujeitos familiares / do grupo em comparação com outros desconhecidos, mas definiram familiaridade e participação no grupo não com base nas relações pessoais entre os indivíduos. Em vez disso, familiaridade ou filiação ao grupo foram definidas com base no conhecimento indireto (por exemplo, foto de pessoas famosas ou de um sujeito já mostrado nas fases pré-julgamento) ou raça comum (por exemplo, Buttle e Raymond, 2003; Ganel e Goshen- Gottstein, 2004; Jackson e Raymond, 2006; Michel et al., 2006). Essa definição é adequada para os fins desses estudos, mas não é tão adequada se os resultados forem usados para propor explicações alternativas para a influência que laços sociais reais – baseados em relações reais – podem ter sobre um fenômeno, neste caso o contágio do bocejo . Por exemplo, Michel et al. (2006) observaram que indivíduos caucasianos e asiáticos podiam reconhecer melhor os rostos da mesma raça, mas essa diferença não estava presente em indivíduos asiáticos que viviam há cerca de um ano entre os caucasianos. Outro ponto de discussão diz respeito à presença de contágio de bocejo em crianças com transtorno do espectro do autismo (TEA), que frequentemente apresentam alterações na atenção visual (Richard e Lajiness-O’Neill, 2015). Em crianças com TEA, o contágio do bocejo pode estar ausente (Senju et al., 2007), prejudicado (Helt et al., 2010) ou semelhante a crianças com desenvolvimento típico quando os sujeitos são induzidos a redirecionar sua atenção para o estímulo de vídeo durante os testes experimentais (Usui et al., 2013). Em um estudo recente, Mariscal et al. (2019) descobriram que o contágio do bocejo em crianças com TEA estava positivamente relacionado à concentração sanguínea de ocitocina, o hormônio envolvido no apego parental e social (Decety et al., 2016) e postulou que o contágio do bocejo em crianças com TEA pode estar relacionado à média variável concentrações de oxitocina em diferentes coortes de estudo (Mariscal et al., 2019). Esta descoberta está de acordo com a hipótese EBH que liga as taxas de contágio de bocejo a laços sociais, o que pode refletir laços emocionais.
Conclusão
Nosso estudo adiciona à discussão sobre os mecanismos subjacentes ao assimetria social no contágio do bocejo (para uma revisão crítica: ver Adriaense et al., 2020; Palagi et al., 2020), mostrando que o contágio do bocejo está provavelmente associado com a atenção seletiva de baixo para cima, em vez de de cima para baixo. A atenção de baixo para cima é conduzida principalmente pela percepção sensorial do estímulo eliciador, enquanto a atenção de cima para baixo seletiva é um processo voluntário e sustentado em que um item específico é selecionado internamente e focalizado ou examinado (Katsuki e Constantinidis, 2014). A este respeito, o estímulo acústico (bocejo auditivo) emitido pelo gatilho foi ouvido e poderia eliciar uma resposta de bocejo no receptor, mesmo que o receptor não estivesse prestando nenhuma atenção visual voluntária ao gatilho. Além disso, as taxas de resposta ao bocejo foram socialmente moduladas, com o contágio auditivo do bocejo sendo mais alto em indivíduos que estavam mais fortemente ligados uns aos outros. Conseqüentemente, a atenção seletiva de cima para baixo não é o principal impulsionador da assimetria social observada no contágio do bocejo, que parece ser um fenômeno impulsionado por estímulos relacionado aos processos de atenção de baixo para cima. É necessária uma investigação mais aprofundada para compreender se e de que maneira outras formas de atenção ou estágios pré-atentos são capazes de afetar o contágio do bocejo.
Declaração de disponibilidade de dados
O conjunto de dados usado para este estudo é fornecido no Material Suplementar.
Declaração de Ética
O estudo envolvendo participantes humanos foi revisado e aprovado pelo Comitato di Bioetica dAteneo (Comitê de Bioética da Universidade) – Universidade de Torino (ref . no. 451945).O consentimento informado por escrito para a participação não foi exigido para este estudo de acordo com a legislação nacional e os requisitos institucionais.
Contribuições dos autores
IN e EP realizaram a coleta de dados e conceberam e escreveram manuscrito. AZ ajudou na coleta de dados e revisão do manuscrito, figuras e tabelas. MG realizou análises estatísticas e escreveu a parte relacionada do manuscrito.
Conflito de interesses
Os autores declaram que a pesquisa foi realizada na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretado como um potencial conflito de interesses.
Agradecimentos
Os autores desejam agradecer ao Prof. Roberto Barbuti e à Prof. Cristina Giacoma por terem apoiado a pesquisa na Universidade de Pisa e na Universidade de Torino, respectivamente.
Material Suplementar
Altmann, J. (1974). Estudo observacional do comportamento: métodos de amostragem. Behavior 49, 227–266. doi: 10.1163 / 156853974×00534
Resumo PubMed | CrossRef Full Text | Google Scholar
Anderson, J. R. e Meno, P. (2003). Influências psicológicas no bocejo em crianças. Curr. Psychol. Lett. 11, 1–7.
Google Scholar
Bartholomew, A. J. e Cirulli, E. T. (2014). A variação individual na suscetibilidade ao bocejo contagioso é altamente estável e amplamente inexplicada pela empatia ou outros fatores conhecidos. PLoS One 9: e91773. doi: 10.1371 / journal.pone.0091773
PubMed Resumo | CrossRef Full Text | Google Scholar
Bretz, F., Hothorn, T. e Westfall, P. (2010). Comparações múltiplas usando R. Boca Raton, FL: Chapman & Hall.
Google Scholar
Deputte, BL (1994). Estudo etológico do bocejo em primatas. I. Análise quantitativa e estudo de causalidade em duas espécies de macacos do Velho Mundo (Cercocebus albigena e Macaca fascicularis). Ethology 98, 221–245. doi: 10.1111 / j.1439-0310.1994.tb01073.x
CrossRef Full Text | Google Scholar
Dobson, A. J. (2002). Uma Introdução aos Modelos Lineares Generalizados, 2ª Edn. Boca Raton, FL: Chapman e Hall.
Google Scholar
Katsuki, F., e Constantinidis, C . (2014). Atenção bottom-up e top-down: diferentes processos e sistemas neurais sobrepostos. Neuroscientist 20, 509-521. doi: 10.1177 / 1073858413514136
Resumo PubMed | CrossRef Full Text | Google Scholar
Singer, T. (2006). A base neuronal e a ontogenia da empatia e da leitura da mente: revisão da literatura e implicações para pesquisas futuras. Neurosci. Biobehav. Rev. 30, 855–863. doi: 10.1016 / j.neubiorev.2006.06.011
Resumo PubMed | CrossRef Full Text | Google Scholar
Statistics Canada (2009). Categorias de idade, agrupamentos de ciclo de vida. Ottawa: Statistics Canada.
Google Scholar