O elemento químico lantânio é classificado como lantanídeo e metal de terras raras. Foi descoberto em 1839 por Carl G. Mosander.

Zona de dados
| Classificação: | O lantânio é um lantanídeo e um metal de terras raras | |
| Cor: | branco prateado | |
| Atômico peso: | 138,9055 | |
| Estado: | sólido | |
| Ponto de fusão : | 1540 oC, 1813,2 K | |
| Ponto de ebulição: | 2830 oC, 3103 K | |
| Elétrons: | 57 | |
| Prótons: | 57 | |
| Nêutrons no isótopo mais abundante: | 82 | |
| Cascas de elétrons: | 2,8,18,18, 9,2 | |
| Configuração de elétrons: | 5d1 6s2 | |
| Densidade @ 20oC: | 6,16 g / cm3 |
Mostre mais, incluindo: Calores, Energias, Oxidação,
Reações , Compostos, Raios, Condutividades
| Volume atômico: | 22,5 cm3 / mol |
| Estrutura: | hcp: hexagonal compactado |
| Dureza: | 2,5 mohs |
| Capacidade de calor específico | 0,19 J g-1 K-1 |
| Calor de fusão | 6,20 kJ mol-1 |
| Calor de atomização | 414 kJ mol-1 |
| Calor de vaporização | 400 kJ mol-1 |
| 1ª energia de ionização | 538,1 kJ mol-1 |
| 2ª energia de ionização | 1067 kJ mol-1 |
| 3ª energia de ionização | 1850 kJ mol-1 |
| Afinidade de elétrons | 50 kJ mol-1 |
| Número mínimo de oxidação | 0 |
| Min. número de oxidação comum | 0 |
| Número máximo de oxidação | 3 |
| Máx. oxidação comum não. | 3 |
| Eletronegatividade (escala de Pauling) | 1,1 |
| Polarizabilidade volume | 31,1 Å3 |
| Reação com ar | vigorosa, c / ht ⇒ La2O3 |
| Reação com HNO3 15 M | leve, ⇒ La (NO3) 3 |
| Reação com HCl 6 M | leve, ⇒ H2, LaCl3 |
| Reação com 6 M NaOH | nenhum |
| Óxido ( s) | La2O3 |
| Hidreto (s) | LaH2, LaH3 |
| Cloreto (s) | LaCl3 |
| Raio atômico | 195 pm |
| Raio iônico (1+ íon) | – |
| Raio iônico (2+ íon) | – |
| Raio iônico (3+ íons) | 117,2 pm |
| Raio iônico (1-íon) | – |
| Raio iônico (2-íons) | – |
| Iônico raio (3-íons) | – |
| Condutividade térmica | 13,4 W m-1 K-1 |
| Condutividade elétrica | 1,9 x 106 S m-1 |
| Ponto de congelamento / derretimento: | 1540 oC, 1813,2 K |

O lantânio é usado em muitas aplicações, como iluminação de estúdio, baterias de laptop, lentes de câmera e baterias híbridas de carro.
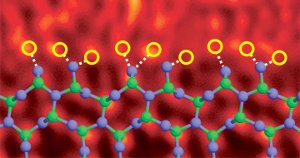
Limite de grão de nitreto de silício dopado com átomos de lantânio. Imagem Ref. (6)
Descoberta de lantânio
O lantânio foi descoberto em 1839 por Carl G. Mosander no mineral cerita em Estocolmo, Suécia.
A céria (óxido de cério) já havia sido descoberta em 1803 pelo químico sueco Jacob Berzelius na cerite mineral. Mosander, que havia sido um dos alunos de Berzelius, suspeitou que a céria era um óxido impuro contendo outras terras raras. (1)
Mosander pegou nitrato de cério em pó fino e adicionou ácido nítrico diluído a frio. Parte do pó de nitrato de cério dissolvido no ácido, indicando que uma nova terra pode estar presente. O novo óxido era mais básico do que a céria (óxido de cério) e, ao contrário da céria, dissolvia-se no ácido.
Mosander separou a solução do precipitado usando oxalato de sódio e calor. Ele obteve um óxido de tijolo claro da nova terra rara. (1)
O nome lanthana para o novo óxido foi sugerido por seu amigo Berzelius.
O nome vem da palavra grega lanthano que significa estar oculto.
Axel Erdmann descobriu o lantânio independentemente no mesmo ano que Mosander em um mineral norueguês recém-descoberto. Erdmann chamou o novo mineral de mosandrita, em homenagem a Mosander.(2)
Mosander obteve lantânio metálico impuro do cloreto. (1)
O metal lantânio puro foi produzido pela primeira vez em 1923 por eletrólise dos haletos fundidos por H. Kremers e R. Stevens.
Mosander continuou estudando a lantana e em 1841 anunciou a descoberta de outra terra rara contida nele. Ele o chamou de ‘didymium’ porque parecia ser ‘um irmão gêmeo inseparável do lantânio’. (2)
‘Didymium’ foi posteriormente mostrado em descobertas separadas como uma mistura de elementos desconhecidos de terras raras. Em 1879, Lecoq de Boisbaudran detectou samário em didímio e separou samário dele. Carl Auer von Welsbach descobriu em 1885 que o “didímio” restante era na verdade uma mistura de dois elementos inteiramente novos: neodímio e praseodímio.


O lantânio é usado em alguns produtos de piscina para reduzir o nível de nutrientes de fosfato que alimentam algas.

No sentido horário a partir do centro superior: óxidos de terras raras de praseodímio, cério, lantânio, neodímio, samário e gadolínio. Foto: LLNL
Aparência e características
Efeitos prejudiciais:
Lantânio e seus compostos são considerados moderadamente tóxicos.
Características:
O lantânio é um metal macio branco prateado, que pode ser cortado com uma faca.
É dúctil , superfícies maleáveis e expostas embaçam rapidamente com o ar formando o óxido.
O lantânio reage com a água para formar hidróxido de lantânio mais gás hidrogênio.
O lantânio é quimicamente reativo e forma compostos com carbono e nitrogênio , boro, selênio, silício, fósforo, enxofre e com os halogênios.
O lantânio geralmente existe como um íon trivalente, La3 +, em seus compostos.
Usos do lantânio
O lantânio é usado em grandes quantidades em baterias recarregáveis de hidreto de níquel metálico (NiMH) para automóveis híbridos. O eletrodo negativo (cátodo) em baterias NiMH é uma mistura de hidretos metálicos – um dos quais é tipicamente hidreto de lantânio. O material ativo no cátodo é o hidrogênio, que é armazenado na estrutura de hidreto metálico. O hidreto metálico pode, dependendo de sua composição, conter entre 1% e 7% de hidrogênio em peso. (3) Uma bateria Toyota Prius requer cerca de 10 kg de lantânio. (4)
O lantânio é usado como um catalisador de craqueamento de petróleo, catalisando a divisão de hidrocarbonetos de cadeia longa em espécies de cadeia mais curta.
O lantânio é usado como um aditivo para fazer ferro fundido nodular e como aditivo em aço.
Pederneiras de isqueiro usam misch metal (uma liga de terras raras) contendo lantânio para produzir faíscas por fricção.
O lantânio é usado em ligas de esponja de hidrogênio, que absorvem até 400 vezes o seu próprio volume de gás hidrogênio.
O lantânio também é usado para fazer óculos de visão noturna (vidro absorvente de infravermelho).
As lentes da câmera e do telescópio de alta qualidade contêm óxido de lantânio (La2O3) fazendo uso de seu alto índice de refração e baixa dispersão.
O carbonato de lantânio é usado para reduzir os níveis de fosfato no sangue em pacientes com doença renal. (5)
Os compostos de lantânio também são usados em alguns produtos para piscinas para reduzir o nível de nutrientes de fosfato de que as algas se alimentam.
Abundância e isótopos
Abundância da crosta terrestre: 34 partes por milhão em peso, 5 partes por milhão em moles
Sistema solar de abundância: 2 partes por bilhão em peso, 0,01 partes por bilhão por moles
Custo puro: $ 800 por 100g
Custo, volume: $ por 100g
Fonte: Lantânio não é encontrado gratuitamente na natureza. É encontrada principalmente nos minerais monazita e bastnaesita. Comercialmente, é recuperado de areia monazítica e bastnaesita usando várias técnicas de extração complexas. O lantânio puro é obtido pela redução do fluoreto com cálcio metálico.
Isótopos: O lantânio possui 31 isótopos cujas meias-vidas são conhecidas, com números de massa de 119 a 150. Destes, um é estável, 139La. O lantânio de ocorrência natural é uma mistura dos dois isótopos 138La e 139La com abundâncias naturais de 0,09% e 99,91%, respectivamente.

Cite esta página
Para links on-line, copie e cole um dos seguintes:
<a href="https://www.chemicool.com/elements/lanthanum.html">Lanthanum</a>
ou
<a href="https://www.chemicool.com/elements/lanthanum.html">Lanthanum Element Facts</a>
Para citar esta página em um documento acadêmico, use a seguinte citação compatível com MLA:
"Lanthanum." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/lanthanum.html>.