A Relação entre Pressão e Volume: Lei de Boyle
Conforme a pressão em um gás aumenta, o volume do gás diminui porque as partículas de gás são forçadas a se aproximar. Por outro lado, conforme a pressão em um gás diminui, o volume do gás aumenta porque o as partículas de gás agora podem se afastar. Os balões meteorológicos ficam maiores à medida que sobem pela atmosfera para regiões de pressão mais baixa porque o volume do gás aumentou; isto é, o gás atmosférico exerce menos pressão na superfície do balão, então o o gás interno se expande até que as pressões interna e externa sejam iguais.
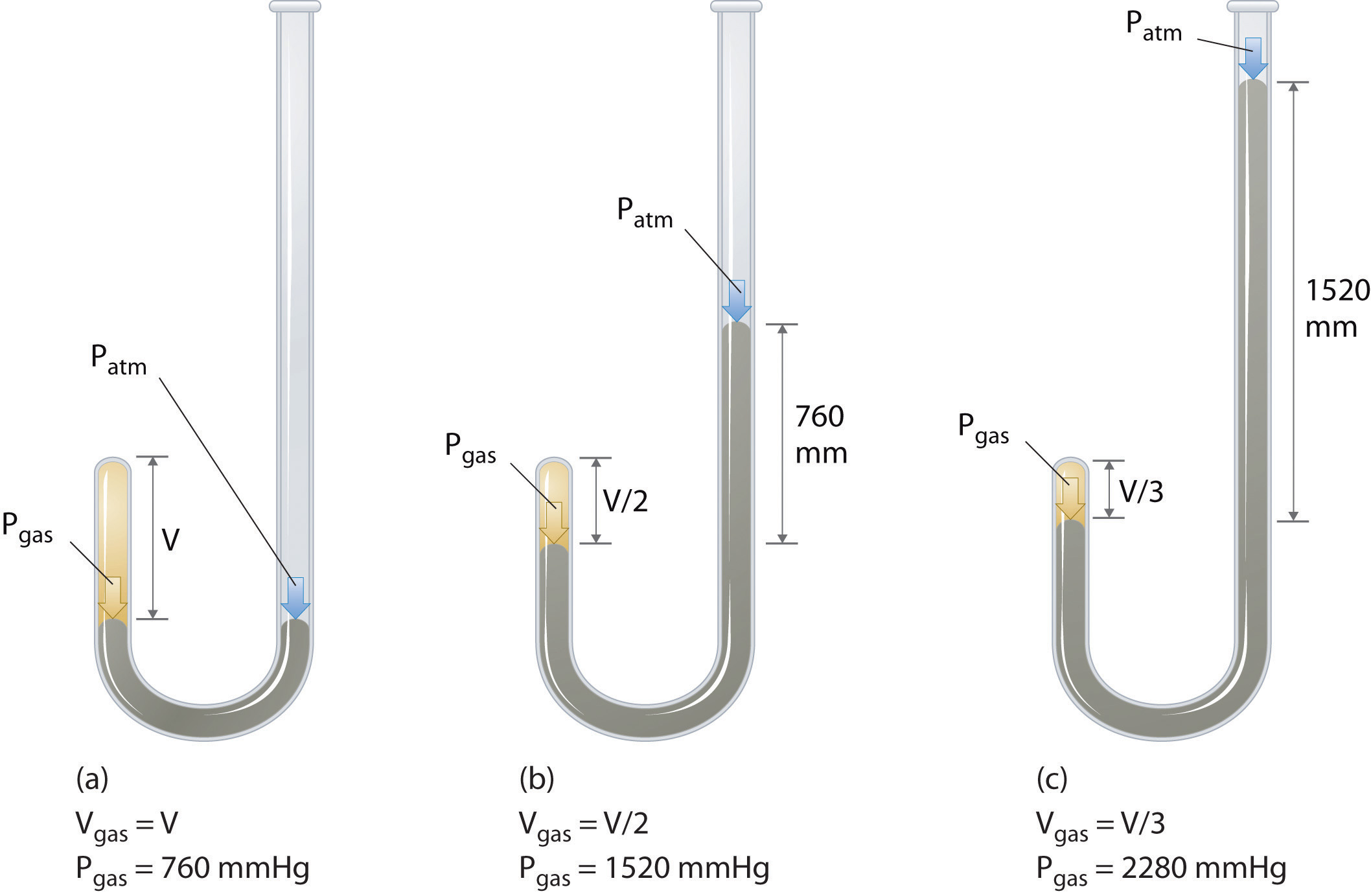
O químico irlandês Robert Boyle (1627-1691) realizou alguns dos primeiros experimentos que determinaram a relação quantitativa entre a pressão e o volume de um gás. Boyle usou um tubo em forma de J parcialmente preenchido com mercúrio, conforme mostrado na Figura \ (\ PageIndex {1} \). Nessas experiências, uma pequena quantidade de um gás ou ar fica presa acima da coluna de mercúrio, e seu volume é medido à pressão atmosférica e temperatura constante. Mais mercúrio é então derramado no braço aberto para aumentar a pressão na amostra de gás. A pressão do gás é a pressão atmosférica mais a diferença nas alturas das colunas de mercúrio e o volume resultante é medido. Este processo é repetido até que não haja mais espaço no braço aberto ou o volume do gás seja muito pequeno para ser medido com precisão. Dados como os de um dos próprios experimentos de Boyle podem ser plotados de várias maneiras (Figura \ (\ PageIndex {2} \)). Um gráfico simples de \ (V \) versus \ (P \) dá uma curva chamada hipérbole e revela uma relação inversa entre pressão e volume: conforme a pressão é dobrada, o volume diminui por um fator de dois. Esta relação entre as duas quantidades é descrita como segue:
\
Dividindo ambos os lados por \ (P \) dá uma equação que ilustra a relação inversa entre \ (P \) e \ (V \):
\
ou
\
onde o símbolo ∝ é lido “é proporcional a”. Um gráfico de V versus 1 / P é, portanto, uma linha reta cuja inclinação é igual à constante nas Equações \ (\ ref {10.3.1} \) e \ (\ ref {10.3.3} \). Dividindo ambos os lados de A equação \ (\ ref {10.3.1} \) por V em vez de P dá uma relação semelhante entre P e 1 / V. O valor numérico da constante depende da quantidade de gás usado no experimento e da temperatura na qual os experimentos são realizados. Essa relação entre pressão e volume é conhecida como lei de Boyle, após seu descobridor, e pode ser expressa da seguinte forma: Em temperatura constante, o volume de uma quantidade fixa de um gás é inversamente proporcional à sua pressão. a lei na prática é mostrada na Figura \ (\ PageIndex {2} \).
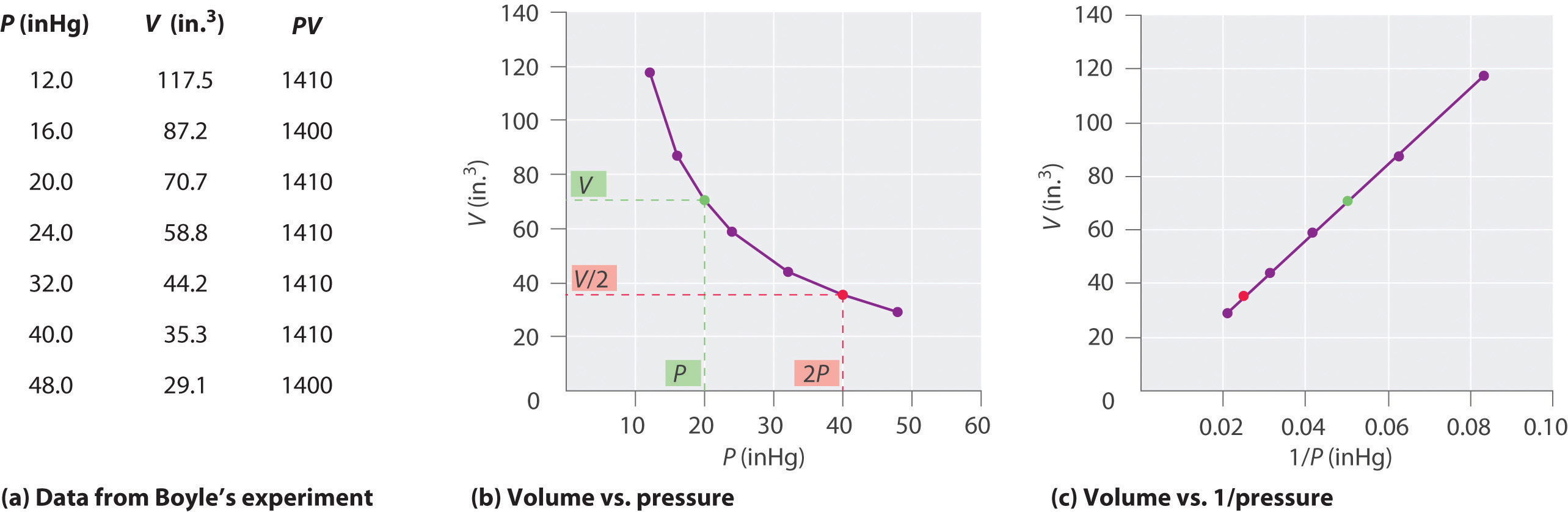
Em temperatura constante, o volume de uma quantidade fixa de um gás é inversamente proporcional à sua pressão