Det kemiske element lanthanum er klassificeret som et lanthanid og sjældent jordmetal. Det blev opdaget i 1839 af Carl G. Mosander.

Datazone
| Klassifikation: | Lanthanum er et lanthanid- og sjældent jordmetal |
| Farve: | sølvhvidt |
| Atomic vægt: | 138.9055 |
| Tilstand: | solid |
| Smeltepunkt : | 1540 oC, 1813,2 K |
| Kogepunkt: | 2830 oC, 3103 K |
| Elektroner: | 57 |
| Protoner: | 57 |
| Neutroner i den mest rigelige isotop: | 82 |
| Elektronskaller: | 2,8,18,18, 9,2 |
| Elektronkonfiguration: | 5d1 6s2 |
| Densitet ved 20oC: | 6,16 g / cm3 |
Vis mere, herunder: Opvarmer, energier, oxidation,
reaktioner , Forbindelser, Radier, Ledningsevne
| Atomvolumen: | 22,5 cm3 / mol |
| Struktur: | hcp: sekskantet tæt pakket |
| Hårdhed: | 2,5 mohs |
| Specifik varmekapacitet | 0,19 J g-1 K-1 |
| Fusionsvarme | 6,20 kJ mol-1 |
| Forstøvningsvarme | 414 kJ mol-1 |
| Varme af fordampning | 400 kJ mol-1 |
| 1. ioniseringsenergi | 538,1 kJ mol-1 |
| 2. ioniseringsenergi | 1067 kJ mol-1 |
| 3. ioniseringsenergi | 1850 kJ mol-1 |
| Elektronaffinitet | 50 kJ mol-1 |
| Minimum oxidationstal | 0 |
| Min. fælles oxidationsnr. | 0 |
| Maksimalt oxidationsnummer | 3 |
| Maks. almindelig oxidationsnr. | 3 |
| Elektronegativitet (Pauling-skala) | 1.1 |
| Polariserbarhed volumen | 31.1 Å3 |
| Reaktion med luft | kraftig, m / ht ⇒ La2O3 |
| Reaktion med 15 M HNO3 | mild, ⇒ La (NO3) 3 |
| Reaktion med 6 M HCI | mild, ⇒ H2, LaCl3 |
| Reaktion med 6 M NaOH | ingen |
| Oxid ( s) | La2O3 |
| Hydrid (er) | LaH2, LaH3 |
| Chlorid (er) | LaCl3 |
| Atomeradius | 195 pm |
| Ionic radius (1+ ion) | – |
| Ionic radius (2+ ion) | – |
| Ionic radius (3+ ion) | 117.2 pm |
| Ionic radius (1- ion) | – |
| Ionic radius (2- ion) | – |
| Ionic radius (3-ion) | – |
| Varmeledningsevne | 13,4 W m-1 K-1 |
| Elektrisk ledningsevne | 1,9 x 106 S m-1 |
| Frysepunkt / smeltepunkt: | 1540 oC, 1813,2 K |

Lanthanum bruges i mange applikationer, såsom studiobelysning, bærbare batterier, kameralinser og hybridbatterier.
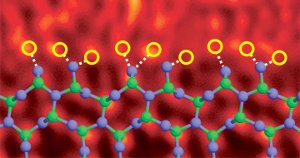
Siliciumnitridkorngrænse doteret med lanthanatomer. Billede ref. (6)
Opdagelse af lanthanum
Lanthanum blev opdaget i 1839 af Carl G. Mosander i mineralet cerit i Stockholm, Sverige.
Ceria (ceriumoxid) var allerede blevet opdaget i 1803 af den svenske kemiker Jacob Berzelius i mineralet cerit. Mosander, som havde været en af Berzelius studerende, mistænkte at ceria var et urent oxid indeholdende andre sjældne jordarter. (1)
Mosander tog fint pulveriseret ceriumnitrat og tilsatte kold fortyndet salpetersyre. Noget af ceriumnitratpulveret opløst i syren, hvilket indikerer en ny jord, kan være til stede. Det nye oxid var mere basisk end ceriumoxid (ceriumoxid) og, i modsætning til ceriumoxid, opløst i syren.
Mosander adskilt opløsningen fra bundfaldet ved hjælp af natriumoxalat og varme. Han fik en bleg murstensfarvet oxid af den nye sjældne jord. (1)
Navnet lanthana for det nye oxid blev foreslået af hans ven Berzelius.
Navnet kommer fra det græske ord lanthano, der betyder at være skjult.
Axel Erdmann opdagede lanthanum uafhængigt samme år som Mosander i et nyligt fundet norsk mineral. Erdmann kaldte det nye mineral mosandrit til ære for Mosander.(2)
Mosander opnåede urent metallisk lanthan fra chloridet. (1)
Rent lanthanmetal blev først produceret i 1923 ved elektrolyse af de smeltede halogenider af H. Kremers og R. Stevens.
Mosander fortsatte med at studere lanthana og annoncerede i 1841 opdagelsen af en anden sjælden jord indeholdt i den. Han kaldte det didymium, fordi det syntes at være en uadskillelig tvillingebror til lanthan. (2)
Didymium blev senere vist i separate opdagelser at være en blanding af ukendte sjældne jordarter. I 1879 opdagede Lecoq de Boisbaudran samarium i didymium og adskilt samarium fra det. Carl Auer von Welsbach opdagede i 1885, at det resterende didymium faktisk var en blanding af to helt nye grundstoffer: neodym og praseodym.


Lanthanum bruges i nogle poolprodukter for at reducere niveauet af fosfatnæringsstoffer, der fodres alger.

Med uret fra øverste centrum: Sjældne jordoxider af praseodym, cerium, lanthan, neodym, samarium og gadolinium. Foto: LLNL
Udseende og egenskaber
Skadelige virkninger:
Lanthanum og dets forbindelser anses for at være moderat giftige.
Karakteristika:
Lanthanum er et sølvhvidt blødt metal, der kan skæres med en kniv.
Det er duktilt , formbare og eksponerede overflader pletter hurtigt i luft, der danner oxidet.
Lanthanum reagerer med vand til dannelse af lanthanhydroxid plus hydrogengas.
Lanthanum er kemisk reaktivt og danner forbindelser med kulstof, nitrogen , bor, selen, silicium, fosfor, svovl og med halogenerne.
Lanthan findes normalt som en trivalent ion, La3 +, i dets forbindelser.
Anvendelse af lanthan
Lanthanum bruges i store mængder i genopladelige nikkelmetalhydridbatterier (NiMH) til hybridbiler. Den negative elektrode (katode) i NiMH-batterier er en blanding af metalhydrider – hvoraf den ene typisk er lanthanhydrid. Det aktive materiale ved katoden er hydrogen, der opbevares i metalhydridstrukturen. Metalhydridet kan, afhængigt af dets sammensætning, indeholde mellem 1 og 7 vægt-% hydrogen. (3) Et Toyota Prius-batteri kræver ca. 10 kg lanthan. (4)
Lanthan anvendes som en petroleumssprængningskatalysator, der katalyserer opdeling af langkædede carbonhydrider til kortere kædearter.
Lanthan bruges som tilsætningsstof til fremstilling af nodulært støbejern og som et additiv i stål.
Flammelignende flints bruger misch metal (en sjælden jordlegering) indeholdende lanthanum til at producere gnister ved friktion.
Lanthanum bruges i brint svamplegeringer, som tager op til 400 gange deres egen volumen brintgas.
Lanthan bruges også til at fremstille nattesynsbriller (infrarødt absorberende glas).
Kamera- og teleskoplinser af høj kvalitet indeholder lanthanumoxid (La2O3), der bruger dets høje brydningsindeks og lave dispersion.
Lanthancarbonat bruges til at reducere blodniveauer af fosfat hos patienter med nyresygdom. (5)
Lanthanforbindelser anvendes også i nogle poolprodukter til at reducere niveauet af fosfatnæringsstoffer, som alger lever af.
Overflod og isotoper
Overflod jordskorpe: 34 vægtdele pr. million, 5 dele pr. million efter mol
Overflod solsystem: 2 dele pr. vægt, 0,01 dele pr. milliard i mol
Omkostninger, ren: $ 800 pr. 100 g
Omkostninger, bulk: $ pr. 100 g
Kilde: Lanthanum findes ikke gratis i naturen. Det findes hovedsageligt i mineralerne monazit og bastnaesit. Kommercielt udvindes det fra monazitsand og bastnaesit ved hjælp af forskellige komplekse ekstraktionsteknikker. Rent lanthan opnås ved reduktion af fluor med calciummetal.
Isotoper: Lanthan har 31 isotoper, hvis halveringstid er kendt med massetal 119 til 150. Af disse er den ene stabil, 139La. Naturligt forekommende lanthan er en blanding af de to isotoper 138La og 139La med naturlige overflader på henholdsvis 0,09% og 99,91%.

Citer denne side
For online-link skal du kopiere og indsætte en af følgende:
<a href="https://www.chemicool.com/elements/lanthanum.html">Lanthanum</a>
eller
<a href="https://www.chemicool.com/elements/lanthanum.html">Lanthanum Element Facts</a>
Hvis du vil citere denne side i et akademisk dokument, skal du bruge følgende MLA-kompatible henvisning:
"Lanthanum." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/lanthanum.html>.