Is flyder, fordi den er mindre tæt end vand. Vand har en densitet på 1,0 g / kubikcentimeter.
Tætheden af is Ih er 0,931 gm / kubikcentimeter.
Men hvorfor er is mindre tæt end vand, hvis begge er lavet op af molekyler af H2O?
————– > spin on ——– > – spin off
—— > space fill / cpk ——– > stick —- > ball-and-stick
For at rotere molekylet — > Venstreklik og træk
For at zoome – > > Venstre klik + hold Skift knap og træk lodret
Jsmol Menu — > > Højreklik
Prøv dette!!
Skift først til wireframe:
Klik på højre museknap over feltet
Stil – > Ordninger – – > wireframe
Etikettatomer:
Style – > Etiket — > atomnummer
Mål følgende vinkler:
< 415
< 512
< 213
< 314
For at måle vinkler: hold venstre musebund over atom og dobbeltklik på atom 1, træk til andet atom (centeratom) enkelt klik centeratom, træk og dobbeltklik atom 3.
—— > space fill / cpk ——– > stick —- > kugle-og-pind
Flydende vand har en delvist ordnet struktur, hvor der konstant dannes hydrogenbindinger og bryde op.
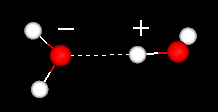
På den anden side har is en stiv gitterstruktur.
I flydende vand er hvert molekyle hydrogenbundet til ca. 3,4 andre vandmolekyler.
I is er hvert molekyle hydrogenbundet til 4 andre molekyler.
Sammenlign de to nedenstående strukturer. Bemærk de tomme rum i isstrukturen.
 |
 |
I is Ih danner hvert vand fire hydrogenbindinger med O — O-afstande på 2,76 Ångstrøm til nærmeste iltnabo. På grund af ordnet struktur i is er der mindre H20-molekyler i et givet rumfang.
Prøv dette –
Prøv dette –
1) Mål OO-afstandene mellem to tilstødende iltatomer i is vist i ovenstående struktur ..
Indtast dit svar i det angivne rum:
I modsætning til is – vand ved stuetemperatur er i konstant bevægelse – der dannes konstant brintbindinger og brydes – klik her for at se vandmolekyler i bevægelse