Forholdet mellem tryk og volumen: Boyles lov
Når trykket på en gas øges, falder gasens volumen, fordi gaspartiklerne tvinges tættere sammen. Omvendt, når trykket på en gas falder, øges gasvolumenet, fordi gaspartikler kan nu bevæge sig længere fra hinanden. Vejrballoner bliver større, når de stiger gennem atmosfæren til områder med lavere tryk, fordi gasens volumen er steget; det vil sige, at den atmosfæriske gas udøver mindre tryk på overfladen af ballonen, så indvendigt gas udvides, indtil det interne og det eksterne tryk er ens.
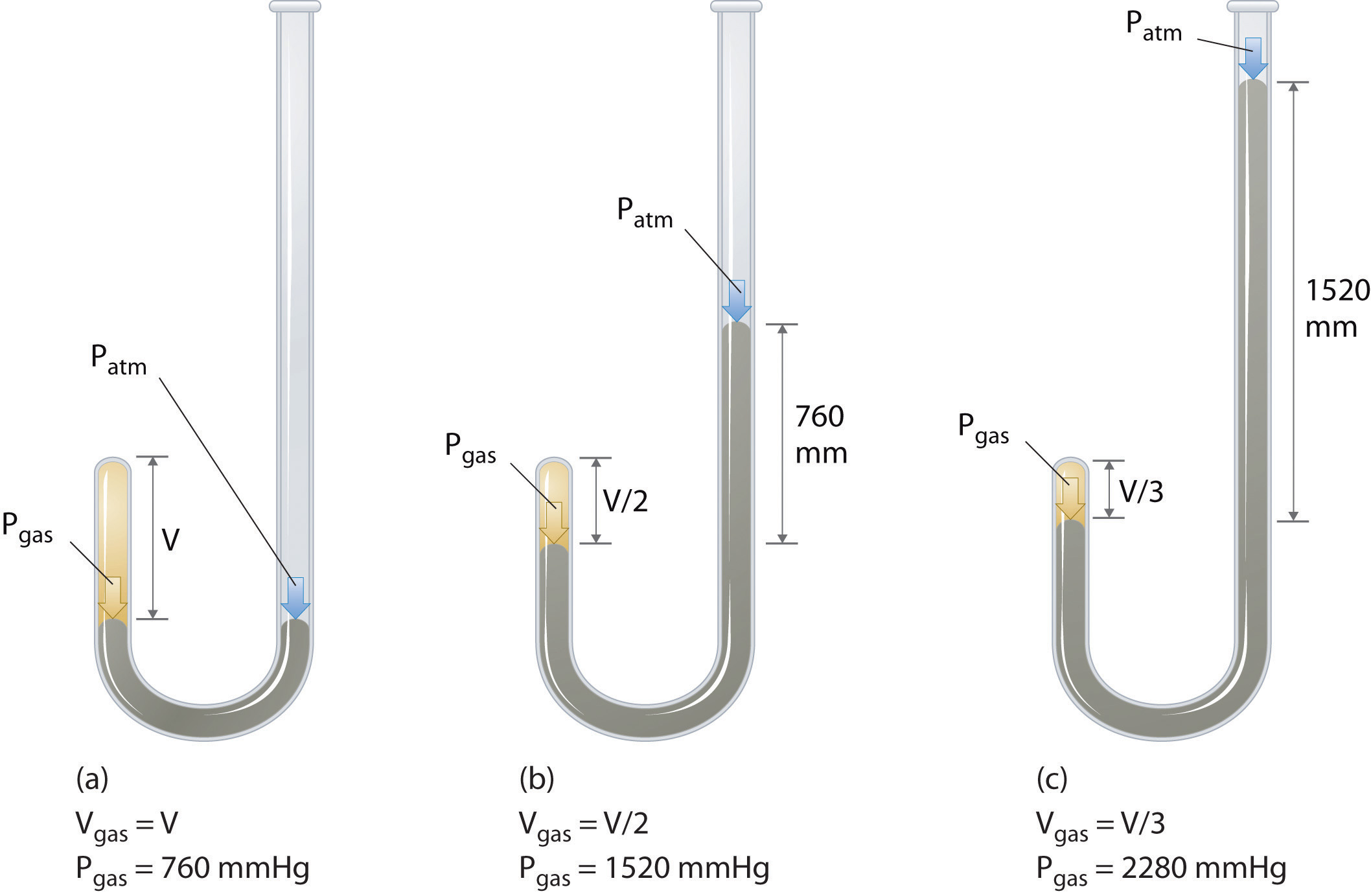
Den irske kemiker Robert Boyle (1627–1691) udførte nogle af de tidligste eksperimenter, der bestemte det kvantitative forhold mellem tryk og volumen af en gas. Boyle brugte et J-formet rør delvist fyldt med kviksølv, som vist i figur \ (\ PageIndex {1} \). I disse eksperimenter fanges en lille mængde af en gas eller luft over kviksølvkolonnen, og dens volumen måles ved atmosfærisk tryk og konstant temperatur. Derefter hældes mere kviksølv i den åbne arm for at øge trykket på gasprøven. Trykket på gassen er atmosfærisk tryk plus forskellen i kviksølvkolonnernes højder, og det resulterende volumen måles. Denne proces gentages, indtil der enten ikke er mere plads i den åbne arm, eller gasens volumen er for lille til at kunne måles nøjagtigt. Data som dem fra et af Boyles egne eksperimenter kan plottes på flere måder (Figur \ (\ PageIndex {2} \)). Et simpelt plot af \ (V \) versus \ (P \) giver en kurve kaldet en hyperbola og afslører et omvendt forhold mellem tryk og volumen: når trykket fordobles, falder lydstyrken med en faktor på to. Dette forhold mellem de to størrelser er beskrevet som følger:
\
At dele begge sider med \ (P \) giver en ligning, der illustrerer det omvendte forhold mellem \ (P \) og \ (V \):
\
eller
\
hvor ∝-symbolet læses “er proportionalt med.” Et plot af V versus 1 / P er således en lige linje, hvis hældning er lig med konstanten i ligninger \ (\ ref {10.3.1} \) og \ (\ ref {10.3.3} \). Deling af begge sider af Ligning \ (\ ref {10.3.1} \) med V i stedet for P giver et lignende forhold mellem P og 1 / V. Den numeriske værdi af konstanten afhænger af mængden af gas, der er brugt i eksperimentet, og af den temperatur, ved hvilken eksperimenterne udføres. Dette forhold mellem tryk og volumen er kendt som Boyles lov efter dets opdagelse og kan angives som følger: Ved konstant temperatur er volumenet af en fast mængde af en gas omvendt proportional med dens tryk. lov i praksis er vist i figur \ (\ PageIndex {2} \).
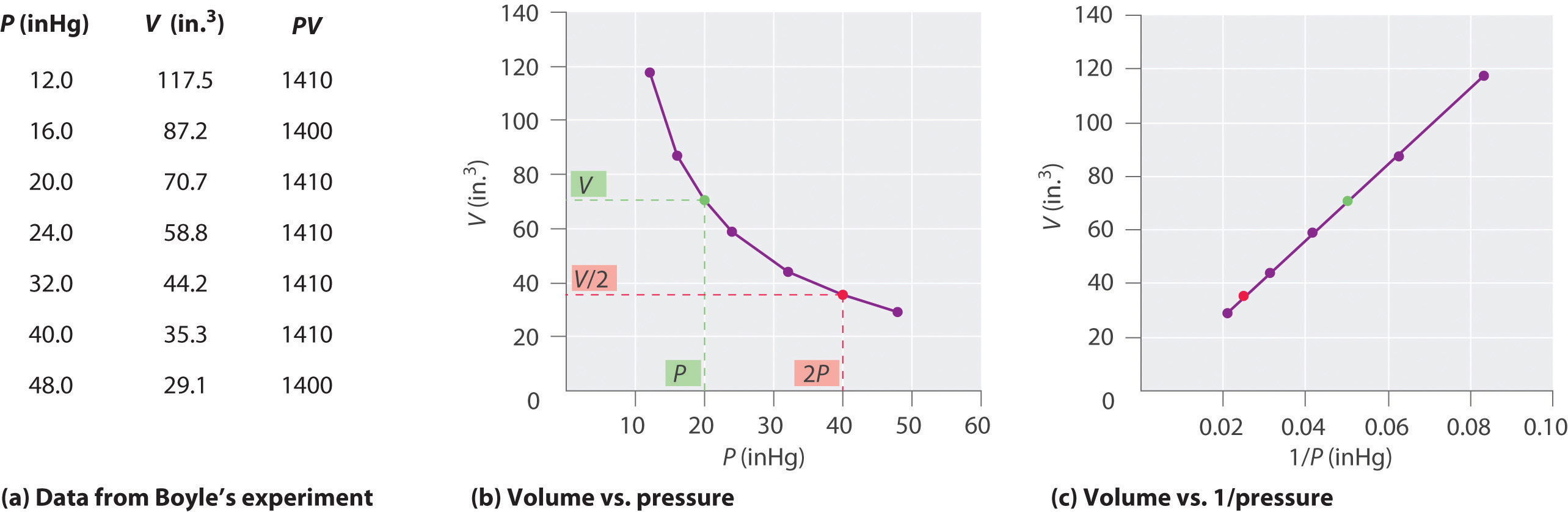
Ved konstant temperatur er volumenet af en fast mængde af en gas omvendt proportional med dens tryk