Chemický prvek lanthan je klasifikován jako lanthanid a kov vzácných zemin. Objevil ji v roce 1839 Carl G. Mosander.

Datová zóna
| Klasifikace: | Lanthan je lanthanid a kov vzácných zemin |
| Barva: | stříbřitě bílá |
| atomová hmotnost: | 138,9055 |
| stav: | pevný |
| bod tání : | 1540 oC, 1813,2 K |
| Bod varu: | 2830 oC, 3103 K |
| Elektrony: | 57 |
| Protony: | 57 |
| Neutrony v nejhojnějším izotopu: | 82 |
| Elektronové granáty: | 2,8,18,18, 9,2 |
| Konfigurace elektronů: | 5d1 6s2 |
| Hustota při 20 ° C: | 6,16 g / cm3 |
Zobrazit více, včetně: Teplo, Energie, Oxidace,
Reakce , Sloučeniny, poloměry, vodivosti
| Atomový objem: | 22,5 cm3 / mol |
| Struktura: | hcp: šestihranný těsně zabalený |
| Tvrdost: | 2,5 mohs |
| Specifická tepelná kapacita | 0,19 J g-1 K-1 |
| Teplo fúze | 6,20 kJ mol-1 |
| atomizační teplo | 414 kJ mol-1 |
| teplo vaporizace | 400 kJ mol-1 |
| 1. ionizační energie | 538,1 kJ mol-1 |
| 2. ionizační energie | 1067 kJ mol-1 |
| 3. ionizační energie | 1850 kJ mol-1 |
| elektronová afinita | 50 kJ mol-1 |
| minimální oxidační číslo | 0 |
| min. společné oxidační číslo. | 0 |
| maximální číslo oxidace | 3 |
| Max. běžné oxidační číslo | 3 |
| elektronegativita (Paulingova stupnice) | 1.1 |
| polarizovatelnost objem | 31,1 Å3 |
| reakce se vzduchem | energický, bez h ⇒ La2O3 |
| Reakce s 15 M HNO3 | mírná, ⇒ La (NO3) 3 |
| Reakce s 6 M HCl | mírný, ⇒ H2, LaCl3 |
| reakce s 6 M NaOH | žádný |
| oxid ( s) | La2O3 |
| Hydride (s) | LaH2, LaH3 |
| Chlorid (y) | LaCl3 |
| Atomový poloměr | 195 pm |
| Iontový poloměr (1+ iont) | – |
| Iontový poloměr (2+ iont) | – |
| Iontový poloměr (3+ iontový) | 117,2 pm |
| Iontový poloměr (1 iontový) | – |
| iontový poloměr (2 ionty) | – |
| iontový poloměr (3 ionty) | – |
| Tepelná vodivost | 13,4 W m-1 K-1 |
| Elektrická vodivost | 1,9 x 106 S m-1 |
| Bod tuhnutí / tání: | 1540 oC, 1813,2 K |

Lanthan se používá v mnoha aplikacích, jako je studiové osvětlení, baterie pro notebooky, objektivy fotoaparátů a hybridní baterie pro automobily.
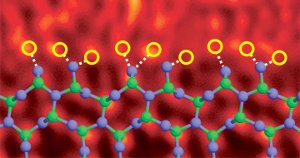
hranice zrn nitridu křemíku dopovaná s atomy lanthanu. Ref. Obrázku (6)
Objev lanthanu
Lanthan byl objeven v roce 1839 Carlem G. Mosanderem v minerálu cerit ve švédském Stockholmu.
Ceria (oxid ceru) byl objeven již v roce 1803 švédským chemikem Jacobem Berzelius v minerálu cerit. Mosander, který byl jedním z Berzeliusových studentů, měl podezření, že ceria je nečistý oxid obsahující jiné vzácné zeminy. (1)
Mosander vzal jemně práškovaný dusičnan ceričitý a přidal studenou zředěnou kyselinu dusičnou. Může být přítomna část prášku dusičnanu ceričitého rozpuštěného v kyselině, což naznačuje novou Zemi. Nový oxid byl zásaditější než ceria (oxid ceru) a na rozdíl od ceria se rozpustil v kyselině.
Mosander oddělil roztok od sraženiny pomocí oxalátu sodného a zahříváním. Získal bledě cihlově zbarvený oxid nové vzácné zeminy. (1)
Název lanthana pro nový oxid navrhl jeho přítel Berzelius.
Název pochází z řeckého slova „lanthano“, což znamená být skrytý.
Axel Erdmann objevil lanthan nezávisle ve stejném roce jako Mosander v nově nalezeném norském minerálu. Erdmann nazval nový minerál mosandritem na počest Mosandera.(2)
Mosander získal z chloridu nečistý kovový lanthan. (1)
Čistý kov lanthanu byl poprvé vyroben v roce 1923 elektrolýzou kondenzovaných halogenidů H. Kremersem a R. Stevensem.
Mosander pokračoval ve studiu lanthany a v roce 1841 oznámil objev další vzácné zeminy v ní obsažené. Pojmenoval jej „didymium“, protože se zdálo, že je „nerozlučným dvojčetem lanthanu.“ (2)
„Didymium“ se později v samostatných objevech ukázalo jako směs neznámých prvků vzácných zemin. V roce 1879 zjistil Lecoq de Boisbaudran samarium v didymu a oddělil od něj samarium. Carl Auer von Welsbach objevil v roce 1885, že zbývající „didymium“ bylo ve skutečnosti směsí dvou zcela nových prvků: neodymu a praseodymu.


Lanthan se používá v některých bazénech ke snížení hladiny fosfátových živin, které krmí řasy.

Ve směru hodinových ručiček od středu nahoře: oxidy vzácných zemin praseodymu, ceru, lanthanu, neodymu, samaria a gadolinia. Foto: LLNL
Vzhled a vlastnosti
Škodlivé účinky:
Lanthan a jeho sloučeniny jsou považovány za mírně toxické.
Charakteristika:
Lanthan je stříbřitě bílý měkký kov, který lze řezat nožem.
Je tvárný , tvárné a exponované povrchy rychle zakalí na vzduchu za vzniku oxidu.
Lanthan reaguje s vodou za vzniku hydroxidu lanthanu plus plynného vodíku.
Lanthan je chemicky reaktivní a tvoří sloučeniny s uhlíkem, dusíkem bór, selen, křemík, fosfor, síra as halogeny.
Lanthan ve svých sloučeninách obvykle existuje jako trojmocný iont La3 +.
Použití lanthanu
Lanthan se používá ve velkém množství v dobíjecích bateriích na bázi niklu a hydridu (NiMH) pro hybridní automobily. Záporná elektroda (katoda) v NiMH baterií je směsí hydridů kovů – jedním z nich je obvykle hydrid lanthanitý. Aktivním materiálem na katodě je vodík, který je uložen ve struktuře hydridu kovu. Hydrid kovu může v závislosti na svém složení obsahovat 1 až 7% hmotnostních vodíku. (3) Baterie Toyota Prius vyžaduje přibližně 10 kg lanthanu. (4)
Lanthan se používá jako katalyzátor krakování ropy, který katalyzuje štěpení uhlovodíků s dlouhým řetězcem na kratší řetězce.
Lanthan se používá jako přísada k výrobě tvárné litiny a jako přísada do oceli.
Plameny zapalovače plamene používají k výrobě jisker třením roztavený kov (slitinu vzácných zemin) obsahující lanthan.
Lanthan se používá ve slitinách vodíkových hub, které mají až 400krát vyšší hodnotu než jejich vlastní objem plynného vodíku.
Lanthan se také používá k výrobě brýlí pro noční vidění (sklo absorbující infračervené záření).
Vysoce kvalitní objektivy fotoaparátů a dalekohledů obsahují oxid lanthanitý (La2O3) využívající má vysoký index lomu a nízkou disperzi.
Uhličitan lanthanitý se používá ke snížení hladiny fosfátů v krvi u pacientů s onemocněním ledvin. (5)
Sloučeniny lanthanu se také používají v některých produktech ke koupání ke snížení hladiny fosfátových živin, kterými se řasy živí.
Hojnost a izotopy
Hojnost zemské kůry: 34 dílů na milion hmotnosti, 5 dílů na milion molů
Hojnost sluneční soustavy: 2 díly na miliardu hmotnost, 0,01 částice na miliardu molů
Čisté náklady: 800 $ za 100 g
Hromadné náklady: $ za 100 g
Zdroj: Lanthan nebyl nalezen zdarma v přírodě. Nachází se hlavně v minerálech monazit a bastnaezit. Komerčně se získává z monazitového písku a bastnaezitu pomocí různých komplexních extrakčních technik. Čistý lanthan se získává redukcí fluoridu kovovým vápníkem.
Izotopy: Lanthan má 31 izotopů, jejichž poločasy jsou známy, s hromadnými čísly 119 až 150. Z nich je jeden stabilní, 139La. Přirozeně se vyskytující lanthan je směsí dvou izotopů 138La a 139La s přirozeným výskytem 0,09% a 99,91%.

Citovat tuto stránku
Chcete-li online odkazovat, zkopírujte a vložte jednu z následujících položek:
<a href="https://www.chemicool.com/elements/lanthanum.html">Lanthanum</a>
nebo
<a href="https://www.chemicool.com/elements/lanthanum.html">Lanthanum Element Facts</a>
Chcete-li citovat tuto stránku v akademickém dokumentu, použijte následující citaci vyhovující MLA:
"Lanthanum." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/lanthanum.html>.