Dowody empiryczne wyjaśniają czynniki ryzyka, przyczyny i interwencje pierwszej linii.
Jeffrey R. Strawn, MD
Kliniczne wykładowca psychiatrii, wydział psychiatrii, University of Cincinnati College of Medicine
Paul E. Keck Jr, MD
Profesor psychiatrii, wydział psychiatrii, University of Cincinnati College of Medicine, prezes i CEO, Lindner Center of HOPE, Cincinnati, OH
Stanley N. Caroff, MD
Profesor psychiatrii, wydział psychiatrii, University of Pennsylvania School of Medicine, szef psychiatrii szpitalnej, oddział psychiatrii, Philadelphia VA Medical Centrum
Diagnostyka i leczenie złośliwego zespołu neuroleptycznego (NMS) są kontrowersyjne, ponieważ ten potencjalnie zagrażający życiu zespół występuje rzadko, a jego objawy są różne. Czynniki te utrudniają ocenę leczenia w kontrolowanych badaniach klinicznych, a dane dotyczące względnej skuteczności określonych interwencji są nieliczne. Możliwe jest jednak opracowanie racjonalnych wytycznych leczenia na podstawie empirycznych danych klinicznych.1,2
W artykule przeanalizowano dowody związane z 6 kontrowersyjnymi aspektami rozpoznawania i leczenia NMS:
• najbardziej wiarygodne czynniki ryzyka
• NMS jako zaburzenie spektralne
• co powoduje NMS
• NMS wywoływane przez leki przeciwpsychotyczne pierwszej i drugiej generacji
• interwencje pierwszej linii
• wznawianie leków przeciwpsychotycznych po epizodzie NMS.
CZY SĄ NIEZAWODNE CZYNNIKI RYZYKA DLA NMS?
W małych badaniach z grupą kontrolną pobudzenie, odwodnienie i wyczerpanie były najczęściej stwierdzanymi czynnikami ogólnoustrojowymi, które, jak się uważa, predysponują pacjentów przyjmujących leki przeciwpsychotyczne do NMS (Tabela 1) .3-5 Katatonia i organiczne zespoły mózgowe mogą być oddzielnymi czynnikami ryzyka.1,6
Wstępne badania również wskazują na nieprawidłowości receptorów dopaminy spowodowane przez polimorfizmy genetyczne lub wpływ niskiego poziomu żelaza w surowicy.1,7, 8 Badania farmakologiczne sugerują, że większe dawki, szybkie dostosowywanie i Zastrzyki domięśniowe leków przeciwpsychotycznych są związane ze zwiększonym ryzykiem NMS.3,5 Niektóre badania sugerują, że 15% do 20% pacjentów z NMS ma w wywiadzie epizody NMS.1,2 Ponadto leki przeciwpsychotyczne pierwszej generacji o dużej sile działania (FGA) – zwłaszcza haloperidol – zakłada się, że niosą większe ryzyko niż leki o niskiej sile działania i leki przeciwpsychotyczne drugiej generacji (SGA), chociaż hipoteza ta jest trudna do udowodnienia.9-11
Te czynniki ryzyka nie są jednak praktyczne do szacowania ryzyka NMS u danego pacjenta, ponieważ są one stosunkowo częste w porównaniu z niskim ryzykiem wystąpienia NMS. W przypadku zdecydowanej większości pacjentów z objawami psychotycznymi korzyści wynikające z właściwie wskazanej farmakoterapii przeciwpsychotycznej przewyższają ryzyko.
Tabela 1 Co zwiększa ryzyko NMS?
- Pobudzenie
- Odwodnienie
- Wyczerpanie
- Niskie stężenie żelaza w surowicy (normalne: 60 do 170 mcg / dl)
Diagnozy
- Historia NMS
- Katatonia
- Organiczne zespoły mózgowe
Centralny układ nerwowy
- Dysfunkcja receptora dopaminy
- Dysfunkcja zwojów podstawnych
- Dysfunkcja współczulnego układu nerwowego
Leczenie farmakologiczne *
- Wstrzyknięcia domięśniowe lub dożylne
- Silni antagoniści dopaminy
- Szybkie dostosowywanie dawki
- Wysokie dawki
- FGA w porównaniu z SGA (?)
* W przypadku poszczególnych pacjentów należy ponownie rozważyć te wspólne czynniki ryzyka korzyści wynikające z terapii przeciwpsychotycznej
FGA: po pierwsze -generacyjne leki przeciwpsychotyczne,
SGA: leki przeciwpsychotyczne drugiej generacji; NMS: złośliwy zespół neuroleptyczny
Źródło: Bibliografia 1-5
CZY NMS ZWIĄZANE Z PARKINSONIZMEM, KATATONIĄ CZY HIPERTERMIĄ ZŁOŚLIWĄ?
Parkinsonizm. Niektórzy badacze opisywali NMS jako skrajny przełom parkinsonowski wynikający z przytłaczającej blokady szlaków dopaminowych w mózgu.1,2,12 W tym ujęciu NMS przypomina zespół parkinsonowskiego-hipertermii, który może wystąpić u pacjentów z chorobą Parkinsona po nagłym odstawieniu lub utracie skuteczność terapii dopaminergicznej, którą można leczyć przez przywrócenie leków dopaminergicznych13. Dowody na poparcie tego poglądu obejmują:
• Objawy parkinsonizmu są podstawową cechą NMS.
• Wycofanie agonistów dopaminy przyspiesza zespół.
• Wszystkie leki wyzwalające są antagonistami receptorów dopaminergicznych.
• Ryzyko wystąpienia NMS koreluje z powinowactwem leków do receptorów dopaminergicznych.
• Agoniści dopaminergiczni mogą być skutecznym leczeniem.
• Zmiany na szlakach dopaminergicznych powodują podobny zespół.
• Pacjenci z NMS wykazują niskie stężenia metabolitu dopaminy, kwasu homowanilinowego, w płynie mózgowo-rdzeniowym.14
Katatonia. Fink i wsp.15 i inni16-18 przekonująco argumentowali, że NMS reprezentuje postać polekowej złośliwej katatonii. Dowody na poparcie tego obejmują:
• Te dwa zaburzenia mają wspólne objawy neuropsychiatryczne.
• Objawy katatoniczne są powszechne w NMS.19
• Katatonia złośliwa i NMS mają wspólne objawy fizjologiczne i laboratoryjne.20
• Ponowne wprowadzenie leków przeciwpsychotycznych może ostro pogorszyć oba stany.
• Benzodiazepiny i terapia elektrowstrząsami (EW ) są skutecznymi metodami leczenia obu zaburzeń.15-18
Lee21 zbadał związek między objawami katatonicznymi a odpowiedzią na leczenie u 14 pacjentów z NMS. Większość pacjentów z objawami katatonicznymi zareagowała na benzodiazepiny, podczas gdy żaden z tych, którzy mieli objawy pozapiramidowo-hipertermiczne bez katatonii, nie zareagował. Lee doszedł do wniosku, że NMS jest niejednorodny i może występować w postaci katatonicznej i niekatatonicznej, które różnią się odpowiedzią na leczenie.
Hipertermia złośliwa. Niektórzy klinicyści porównali NMS ze złośliwą hipertermią wywołaną wziewnymi środkami znieczulającymi i sukcynylocholiną.1,2 Dowody obejmują:
• podobne objawy kliniczne sztywności, hipertermii i hipermetabolizmu
• podobne objawy fizjologiczne i laboratoryjne, takie jak rabdomioliza
• hipertermia w obu przypadkach odpowiadających na dantrolen.
Chociaż objawy 2 są podobne w obrazie, hipertermia złośliwa występuje śródoperacyjnie i odzwierciedla farmakogenetyczne zaburzenie regulacji wapnia w mięśniach szkieletowych. Ponadto sztywność w hipertermii złośliwej nie reaguje na leki zwiotczające mięśnie działające obwodowo.1,22 Dowody sugerują, że pacjenci, którzy wcześniej doświadczyli epizodu NMS, nie są narażeni na ryzyko hipertermii złośliwej.22
CO TO JEST PATOFIZJOLOGIA OF NMS?
Patofizjologia NMS jest złożona i prawdopodobnie obejmuje wzajemne oddziaływanie wielu szlaków centralnych i systemowych oraz neuroprzekaźników. Jak opisano powyżej, przekonujące dowody sugerują, że blokada dopaminy odgrywa kluczową rolę.12
Uważa się, że blokada dopaminy w podwzgórzu przyczynia się do niewydolności termoregulacyjnej, a blokada w układzie nigrostriatalnym prawdopodobnie przyczynia się do sztywności mięśni i hipermetabolizmu. Utrata dopaminergicznego dopływu do przedniego zakrętu obręczy-przyśrodkowego obwodu oczodołowo-czołowego i bocznego obwodu oczodołowo-czołowego prawdopodobnie przyczynia się do zmian stanu psychicznego i objawów katatonicznych obserwowanych w NMS. 12
Jednak niektórzy badacze zaproponowali konkurencyjne lub uzupełniające się hipotezy. Na przykład Gurrera 23 zaproponował, że pacjenci ze skłonnością do rozwoju NMS są podatni na hiperaktywny i rozregulowany współczulny układ nerwowy, a ta cecha – wraz z zaburzeniami układu dopaminowego wywołanymi przez leki blokujące dopaminę – powoduje NMS. Inni badacze powiązali mechanizmy serotoniny, norepinefryny, kwasu gamma-aminomasłowego i glutaminergicznego. 1,12,24,25
CZY FGAS CZY SGAS MOGĄ WIĘCEJ POWODOWAĆ NMS?
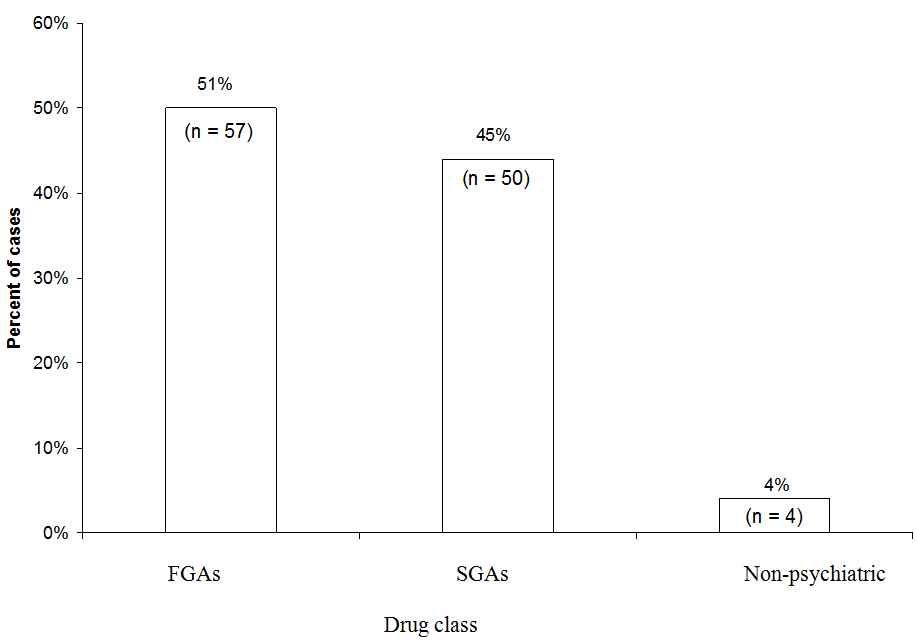
FGA: lek przeciwpsychotyczny pierwszej generacji
SGA: lek przeciwpsychotyczny drugiej generacji
Nieznacznie więcej przypadków NMS przypisano FGAs (51%) niż SGAs (45%) w analizie 111 przypadków prawdopodobnych lub określonych NMS związanych z pojedynczym lekiem zgłoszonych na gorącą linię NMS w latach 1997–2006. Haloperidol FGA stanowił 44% wszystkich przypadków. Określenie „medyczne” odnosi się do przypadków, w których neuroleptyk był stosowany w warunkach innych niż psychiatryczne.
Źródło: niepublikowane dane zgromadzone w Neuroleptic Malignant Syndrome Information Service.
Zakłada się, że NMS występuje rzadziej u pacjentów leczonych SGA niż u pacjentów otrzymujących FGA, chociaż ta hipoteza jest nieudowodniona. Pojedyncze doniesienia o NMS były powiązane z prawie każdym SGA.9-11 Jest to trudno udowodnić zobowiązania FGA vs SGA, ponieważ:
• NMS jest rzadkie.
• Praktyki dawkowania mogą być obecnie bardziej konserwatywne niż w przeszłości.
• Większość lekarzy zdaje sobie sprawę z wczesnych objawów NMS.
W badaniu epidemiologicznym dużej bazy danych Stubner i wsp. 26 wykazali, że pacjenci otrzymujący SGA mieli mniejsze ryzyko NMS niż ci leczeni haloperidolem.26 W tym badaniu ogólny wskaźnik NMS wynosił 0,02%.
Dane z gorącej linii NMS. Niedawno zbadaliśmy, które klasy leków były zaangażowane w 111 przypadków NMS zgłoszonych do Neuroleptic Malignant S Infolinia Yndrome Information Service (1-888-NMSTEMP) w latach 1997-2006 (rysunek). Uwzględniliśmy tylko przypadki określonego lub prawdopodobnego NMS (zdiagnozowane przez konsultantów infolinii), w których podano jeden lek przeciwpsychotyczny. Nieco więcej przypadków przypisano FGA (51%) niż SGA (45%). Pozostałe przypadki przypisywano neuroleptykom stosowanym w placówkach medycznych (takim jak prometazyna czy prochlorperazyna).
Ponieważ są one obecnie przepisywane rzadziej, FGA stanowiły nieproporcjonalną liczbę przypadków NMS zgłaszanych na gorącą linię. Haloperidol stanowił większość przypadków FGA i 44% wszystkich przypadków. Gdybyśmy wykluczyli haloperidol i porównali ryzyko NMS SGA tylko z FGA o średniej lub niskiej sile działania, względna przewaga SGA zostałaby utracona. Z drugiej strony jasne jest, że SGA nadal niosą ze sobą ryzyko dla NMS.
Analizy sugerują, że klasyczne cechy NMS związane z SGA – gorączka, sztywność mięśni oraz zmiany stanu autonomicznego i psychicznego – są utrzymywane u pacjentów otrzymujących SGA, chociaż niektórzy mogą nie wykazywać ciężkiej sztywności i ekstremalnych temperatur, typowych u pacjentów otrzymujących FGA .9-11 Łagodniejsze cechy kliniczne związane z SGA mogą odzwierciedlać bardziej konserwatywne wzorce przepisywania lub zwiększoną świadomość i wcześniejsze rozpoznawanie NMS, co zapobiegałoby piorunującym objawom.
JAKIE SĄ DOWODY NA OKREŚLONE LECZENIA NMS?
NMS jest rzadki, jego prezentacja jest różna, a jego postęp jest nieprzewidywalny. Czynniki te utrudniają ocenę leczenia w kontrolowanych badaniach klinicznych, a dane dotyczące względnej skuteczności określonych interwencji są skąpe.
Mimo to pogląd, że NMS stanowi skrajny wariant parkinsonizmu wywołanego lekami lub katatonii, sugeruje, że konkretne NMS leczenie może być oparte na nasileniu objawów lub stadium objawów. Proponujemy wytyczne leczenia oparte na mechanizmach teoretycznych i niepotwierdzonych danych.2,27-29
Wsparcie. Po natychmiastowym odstawieniu szkodliwego leku, podstawą leczenia NMS jest terapia wspomagająca.1,2,27
W przypadku pacjentów z łagodnymi objawami przedmiotowymi i podmiotowymi, wystarczająca może być opieka wspomagająca i uważne monitorowanie kliniczne. Ekstremalna hipertermia wymaga resuscytacji objętościowej i środków ochłodzenia, intensywnej opieki medycznej i uważnego monitorowania powikłań.
Leczenie. Pomimo braku zgody co do leczenia farmakologicznego niepowikłanych ZZN, około 40% pacjentów z ostrym ZZN jest leczonych farmakologicznie. 2
Lorazepam w dawce 1 do 2 mg pozajelitowo jest rozsądną terapią pierwszego rzutu w leczeniu NMS, zwłaszcza u osób z NMS. objawy katatoniczne.4,15-18,21,30,31 Niektórzy badacze zalecają większe dawki.15 Benzodiazepiny są preferowane, jeśli wymagana jest sedacja u pobudzonych pacjentów z NMS.4,15-18
Środki dopaminergiczne, takie jak bromokryptyna i amantadyna, nasilają działanie dopaminergiczne przeniesienie choroby w celu odwrócenia objawów parkinsonizmu i według doniesień skraca czas do wyzdrowienia i zmniejsza o połowę wskaźniki śmiertelności, gdy są stosowane samodzielnie lub w połączeniu z innymi terapiami.13,27,32,33 Szybkie odstawienie tych leków może spowodować objawy z odbicia, chociaż może to być prawdziwe dla każdego konkretnego leczenia farmakologicznego NMS.1,31,32
Dantrolen rozłącza sprzężenie pobudzenie-skurcz, zwiększając sekwestrację wapnia w siateczce sarkoplazmatycznej w mięśniach szkieletowych i był ed w leczeniu objawów hipermetabolicznych NMS. W niektórych przeglądach stwierdzono poprawę nawet u 80% pacjentów z NMS leczonych dantrolenem w monoterapii.27, 32-35 W porównaniu z leczeniem wspomagającym, czas do wyzdrowienia może być skrócony – a śmiertelność zmniejszona o prawie połowę – gdy dantrolen jest stosowany samodzielnie lub w w połączeniu z innymi lekami.
Nie wszystkie opisy przypadków wykazały, że dantrolen, benzodiazepiny lub agoniści dopaminergiczni są skuteczni w leczeniu NMS.31,36 Naszym zdaniem tylko zaawansowane przypadki NMS – z ekstremalnym wzrostem temperatury, ciężkimi sztywność i dowody ogólnoustrojowego hipermetabolizmu – korzyść z leczenia dantrolenem.1,2
EW jest z powodzeniem stosowana w celu zmniejszenia śmiertelności z powodu NMS i innych zaburzeń ze spektrum katatonicznego. Zwykle stosuje się ją po terapii wspomagającej i niepowodzeniu interwencji psychofarmakologicznych.2,15,16,27,37 EW w ostrym NMS składa się zazwyczaj z serii 6 do 10 zabiegów z obustronnym umieszczeniem elektrod. Początkowo może być konieczna codzienna EW.15
CZY ANTYPSYCHOTYKI SĄ PRZECIWWSKAZANE PO ODCIĄŻENIU NMS? U% pacjentów może wystąpić ryzyko nawrotu NMS po ponownym podaniu leku przeciwpsychotycznego.1 Jednak stosując odpowiednie środki ostrożności (tabela 2) można bezpiecznie leczyć większość pacjentów wymagających ciągłej terapii przeciwpsychotycznej.1,2
Po wznowieniu leczenia , zgodnie z retrospektywnymi analizami ograniczonych dostępnych danych, lek przeciwpsychotyczny o mniejszej sile działania z innej klasy chemicznej może być bezpieczniejszą opcją niż ponowna próba podania środka wyzwalającego. Pacjent, u którego rozwinie się NMS w badaniu FGA, może odnieść korzyść z badania SGA, chociaż istnieje pewne ryzyko nawrotu.1,10
Tabela 2 Ponowne wprowadzenie leków przeciwpsychotycznych po epizodzie NMS
Ponownie sprawdź dokładność diagnozy poprzedniego epizodu NMS
Wskazania w dokumencie w przypadku leków przeciwpsychotycznych
Omów ryzyko i korzyści, w tym ryzyko nawrotu, z pacjentem i rodziną
Rozważ alternatywne leki farmakologiczne
Zminimalizuj czynniki ryzyka (Tabela 1)
Przed ponownym podaniem należy poczekać ≥2 tygodnie (≥4 tygodnie w przypadku długo działającego leku do wstrzykiwań) po ustąpieniu epizodu NMS.
Wybierz FGA lub SGA o niskiej sile działania
Przepisanie początkowej dawki testowej
Monitorowanie parametrów życiowych i stanu neurologicznego
Miareczkowanie dawki stopniowo
FGA: leki przeciwpsychotyczne pierwszej generacji;
SGA: leki przeciwpsychotyczne drugiej generacji
Źródło: Bibliografia 1,2
Powiązane zasoby
• Serwis informacyjny dotyczący złośliwego zespołu neuroleptycznego. www.nmsis.org.
• Zarrouf FA, Bhanot V. Złośliwy zespół neuroleptyczny: nie trać jeszcze czujności. Current Psychiatry 2007; 6 (8): 89-95.
Nazwy marek leków
Amantadyna • Symmetrel
Bromokryptyna • Parlodel
Chlorpromazyna • Torazyna
Dantrolen • Dantrium®
Flufenazyna • Proliksyna
Haloperidol • Haldol
Lorazepam • Ativan
Loksapina • Loksytan
Perfenazyna • Trilafon
Prochlorperazyna • Compazine, Compro
Promethazine • Fenergan
Thioridazine • Mellaril
Ujawnienie
Dr. Strawn to Amerykański Instytut Psychiatryczny ds. Badań i Edukacji (APIRE) / stypendysta Janssen.
Dr. Keck otrzymał wsparcie badawcze lub służył jako konsultant Abbott Laboratories, American Diabetes Association, AstraZeneca Pharmaceuticals, Bristol-Myers Squibb, GlaxoSmithKline, Eli Lilly and Company, Janssen Pharmaceutica, National Institute of Mental Health, National Institute of Drug Abuse, Pfizer , Stanley Medical Research Institute i UCB Pharma.
Dr. Caroff otrzymał wsparcie badawcze od Bristol-Myers Squibb, Ortho-McNeil Neurologics i Pfizer.
- Caroff SN. Neuroleptic malignant syndrome, w: Mann SC, Caroff SN, Keck PE Jr, Lazarus A, red. Złośliwy zespół neuroleptyczny i stany pokrewne wyd. Waszyngton, DC: American Psychiatric Publishing Inc; 2003; 1-44.
- Strawn JR, Keck PE Jr, Caroff SN. Złośliwy zespół neuroleptyczny Am J Psychiatry 2007; 164: 870–6.
- Keck PE Jr, Pope HG Jr, Cohen BM, et al. Czynniki ryzyka złośliwego zespołu neuroleptycznego Arch Gen Psychiatry 1989; 46: 914–18.
- Rosebush PI, Stewart TD. Prospektywna analiza 24 epizodów złośliwego zespołu neuroleptycznego Am J Psychiatry 1989; 146: 717–25.
- Berardi D, Amore M, Keck PE Jr, et al. Kliniczne i farmakologiczne czynniki ryzyka złośliwego zespołu neuroleptycznego: badanie kliniczno-kontrolne. Biol Psychiatry 1998; 44: 748–54.
- White DA, Robins AH. Katatonia: zwiastun złośliwego zespołu neuroleptycznego Br J Psychiatry 1991; 158: 419–21.
- Rosebush PI, Mazurek MF. Żelazo w surowicy i złośliwy zespół neuroleptyczny. Lancet 1991; 338: 149–51.
- Lee JW. Żelazo w surowicy w przypadku katatonii i złośliwego zespołu neuroleptycznego Biol Psychiatry 1998; 44: 499–507.
- Ananth J, Parameswaran S, Gunatilake S, et al. Złośliwy zespół neuroleptyczny i atypowe leki przeciwpsychotyczne J Clin Psychiatry 2004; 65: 464–70.
- Caroff SN, Mann SC, Campbell EC. Nietypowe leki przeciwpsychotyczne i złośliwy zespół neuroleptyczny Psychiatr Ann 2000; 30: 314–21.
- Hasan S, Buckley P. Novel antpsychotics and the neuroleptic malignant syndrome Am J Psychiatry 1998; 155: 1113–16.
- Mann SC, Caroff SN, Fricchione G, Campbell EC. Centralna hipoaktywność dopaminy i patogeneza złośliwego zespołu neuroleptycznego Psychiatr Ann 2000; 30: 363–74.
- Factor SA, Santiago A. Zespół parkinsonizmu-hiperpyreksji w chorobie Parkinsona. W: Frucht SJ, Fahn S, red. . Nagłe zaburzenia ruchu: diagnostyka i leczenie. Totowa, NJ: Humana Press; 2005; 29-40.
- Nisijima K, Ishiguro T. Poziomy metabolitów monoamin i kwasu gamma-aminomasłowego w płynie mózgowo-rdzeniowym w złośliwym zespole neuroleptycznym. J Psychiatr Res 1995; 27: 233–44.
- Fink M, Taylor MA. Złośliwy zespół neuroleptyczny to złośliwa katatonia, uzasadniająca skuteczne leczenie katatonii. Prog Neuropsychopharmacol Biol Psychiatry 2006; 30: 1182–3.
- Fricchione G, Bush G, Fozdar M, et al. Rozpoznawanie i leczenie zespołu katatonicznego. J Intensive Care Med 1997; 12: 135–47.
- Philbrick KL, Rummans TA. Złośliwa katatonia. J Neuropsychiatry Clin Neurosci 1994; 6: 1–13.
- Mann SC, Caroff SN, Bleier HR, et al. Śmiertelna katatonia. Am J Psychiatry 1986; 143: 1374–81.
- Koch M, Chandragiri S, Rizvi S, et al. Objawy katatoniczne w złośliwym zespole neuroleptycznym. Compr Psychiatry 2000; 41: 73–5.
- Lee JW. Wyniki laboratoryjne. W: Caroff SN, Mann SC, Francis A, Fricchoine GL, red. Katatonia: od psychopatologii do neurobiologii. Waszyngton: American Psychiatric Press, Inc; 2004; 65–75.
- Lee JW.Warianty katatoniczne, hipertermiczne reakcje pozapiramidowe i podtypy złośliwego zespołu neuroleptycznego. Ann Clin Psychiatry 2007; 19: 9–16.
- Caroff SN, Rosenberg H, Mann SC, et al. Złośliwy zespół neuroleptyczny w okresie okołooperacyjnym. Am J Anesthesiol 2001; 28: 387–93.
- Gurrera RJ. Nadpobudliwość współczulno-nadnercza i etiologia złośliwego zespołu neuroleptycznego. Am J Psychiatry 1999; 156: 169–80.
- Carroll BT. Hipoteza pola uniwersalnego katatonii i złośliwego zespołu neuroleptycznego. CNS Spectr 2000; 5: 26–33.
- Weller M, Kornhuber J. Rationale for NMDA receptor antagonist therapy of the neuroleptic malignant syndrome. Med Hypotheses 1992; 38: 329–33.
- Stubner S, Rustenbeck E, Grohmann R, et al. Ciężkie i niezbyt częste mimowolne zaburzenia ruchu spowodowane lekami psychotropowymi. Pharmacopsychiatry 2004; 37 (supl. 1): S54 – S64.
- Davis JM, Caroff SN, Mann SC. Leczenie złośliwego zespołu neuroleptycznego. Psychiatr Ann 2000; 30: 325–31.
- Adityanjee PA, Singh S, Singh G, Ong S. Spectrum concept of neuroleptic malignant syndrome. Br J Psychiatry 1988; 153: 107–11.
- Woodbury MM, Woodbury MA. Katatonia wywołana neuroleptycznie jako etap progresji w kierunku złośliwego zespołu neuroleptycznego. J Am Acad Child Adolesc Psychiatry 1992; 31: 1161–4.
- Francis A, Chondragivi S, Rizvi S, et al. Czy lorazepam jest lekiem na złośliwy zespół neuroleptyczny? CNS Spectr 2000; 5: 54–7.
- Rosebush PI, Stewart T, Mazurek MF. Leczenie złośliwego zespołu neuroleptycznego. Czy dantrolen i bromokryptyna są przydatnymi dodatkami w leczeniu wspomagającym? Br J Psychiatry 1991; 159: 709–12.
- Sakkas P, Davis JM, Janicak PG, Wang ZY. Leczenie farmakologiczne złośliwego zespołu neuroleptycznego. Psychopharmacol Bull 1991; 27: 381–4.
- Rosenberg MR, Green M. Neuroleptic malignant syndrome: review of response to therapy. Arch Intern Med 1989; 149: 1927–31.
- Yamawaki S, Morio M, Kazamutsuri G, et al. Ocena kliniczna i skuteczne zastosowanie soli sodowej dantrolenu w złośliwym zespole neuroleptycznym. Kiso to Rinsyou (Clinical Reports) 1993; 27: 1045–66.
- Tsutsumi Y, Yamamoto K, Matsuura S, et al. Leczenie złośliwego zespołu neuroleptycznego przy użyciu soli sodowej dantrolenu. Psychiatry Clin Neurosci 1998; 52: 433–8.
- Reulbach U, Dutsch C, Biermann T, et al. Zarządzanie skutecznym leczeniem złośliwego zespołu neuroleptycznego. Crit Care 2007; 11: R4.
- Troller JN, Sachdev PS. Elektrowstrząsowe leczenie złośliwego zespołu neuroleptycznego: przegląd i opis przypadków. Aust N Z J Psychiatry 1999; 33: 650–9.
- Papież HG, Aizley HG, Keck PE Jr, McElroy SL. Złośliwy zespół neuroleptyczny: długoterminowa obserwacja 20 przypadków. J Clin Psychiatry 1991; 52: 208–12.