Pierwiastek chemiczny lantan jest klasyfikowany jako lantanowiec i metal ziem rzadkich. Został odkryty w 1839 roku przez Carla G. Mosandera.

Strefa danych
| Klasyfikacja: | Lantan to lantanowiec i metal ziem rzadkich |
| Kolor: | srebrno-biały |
| Atomowy waga: | 138.9055 |
| Stan: | solid |
| Temperatura topnienia : | 1540 oC, 1813,2 K |
| Temperatura wrzenia: | 2830 oC, 3103 K |
| Elektrony: | 57 |
| Protony: | 57 |
| Neutrony w większości izotopów: | 82 |
| Powłoki elektronów: | 2,8,18,18, 9,2 |
| Konfiguracja elektronowa: | 5d1 6s2 |
| Gęstość @ 20oC: | 6,16 g / cm3 |
Pokaż więcej, w tym: Ciepła, Energie, Utlenianie,
Reakcje , Związki, promienie, przewodnictwo
| Objętość atomowa: | 22,5 cm3 / mol |
| Struktura: | hcp: sześciokątny ściśle upakowany |
| Twardość: | 2,5 mohs |
| Ciepło właściwe | 0,19 J g-1 K-1 |
| Ciepło topnienia | 6,20 kJ mol-1 |
| Ciepło atomizacji | 414 kJ mol-1 |
| Ciepło odparowanie | 400 kJ mol-1 |
| Pierwsza energia jonizacji | 538,1 kJ mol-1 |
| Druga energia jonizacji | 1067 kJ mol-1 |
| trzecia energia jonizacji | 1850 kJ mol-1 |
| Powinowactwo elektronowe | 50 kJ mol-1 |
| Minimalny stopień utlenienia | 0 |
| Min. wspólny nr utlenienia | 0 |
| Maksymalny stopień utlenienia | 3 |
| Max. wspólny nr utleniania | 3 |
| Elektroujemność (skala Paulinga) | 1.1 |
| Polaryzowalność głośność | 31,1 Å3 |
| Reakcja z powietrzem | energiczna, w / ht ⇒ La2O3 |
| Reakcja z 15 M HNO3 | łagodne, ⇒ La (NO3) 3 |
| Reakcja z 6 M HCl | łagodne, ⇒ H2, LaCl3 |
| Reakcja z 6 M NaOH | brak |
| Tlenek ( s) | La2O3 |
| Wodork (y) | LaH2, LaH3 |
| Chlorek (i) | LaCl3 |
| Promień atomowy | 195 pm |
| Promień jonowy (jon 1+) | – |
| Promień jonowy (jon 2+) | – |
| Promień jonowy (3+ jony) | 117,2 pm |
| Promień jonowy (1-jonowy) | – |
| Promień jonowy (2-jonowy) | – |
| Jonowy promień (3-jonowy) | – |
| Przewodność cieplna | 13,4 W m-1 K-1 |
| Przewodność elektryczna | 1,9 x 106 S m-1 |
| Temperatura krzepnięcia / topnienia: | 1540 oC, 1813,2 K |

Lantan jest używany w wielu zastosowaniach, takich jak oświetlenie studyjne, baterie do laptopów, obiektywy do aparatów i hybrydowe akumulatory samochodowe.
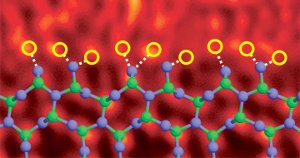
Domieszkowany brzegowo azotkiem krzemu z atomami lantanu. Image Ref. (6)
Odkrycie lantanu
Lantan został odkryty w 1839 roku przez Carla G. Mosandera w minerale cerytu w Sztokholmie w Szwecji.
Ceria (tlenek ceru) została odkryta już w 1803 roku przez szwedzkiego chemika Jacoba Berzelius w minerale ceryt. Mosander, który był jednym z uczniów Berzeliusa, podejrzewał, że ceria jest zanieczyszczonym tlenkiem zawierającym inne metale ziem rzadkich. (1)
Mosander wziął drobno sproszkowany azotan ceru i dodał zimny rozcieńczony kwas azotowy. Część sproszkowanego azotanu ceru rozpuszczona w kwasie wskazuje, że może być obecna nowa ziemia. Nowy tlenek był bardziej zasadowy niż cer (tlenek ceru) i, w przeciwieństwie do ceru, rozpuszczał się w kwasie.
Mosander oddzielił roztwór od osadu za pomocą szczawianu sodu i ogrzewania. Uzyskał tlenek nowej ziemi rzadkiej w kolorze jasnej cegły. (1)
Nazwa lanthana dla nowego tlenku została zaproponowana przez jego przyjaciela Berzeliusa.
Nazwa pochodzi od greckiego słowa „lanthano” oznaczającego być ukrytym.
Axel Erdmann niezależnie odkrył lantan w tym samym roku co Mosander w nowo odkrytym norweskim minerale. Erdmann nazwał nowy mineralny mosandryt na cześć Mosandera.(2)
Mosander uzyskał z chlorku zanieczyszczony metaliczny lantan. (1)
Czysty metal lantanu został po raz pierwszy wyprodukowany w 1923 roku przez elektrolizę stopionych halogenków przez H. Kremersa i R. Stevensa.
Mosander kontynuował badania lantany iw 1841 roku ogłosił odkrycie zawartej w nim innej ziemi rzadkiej. Nazwał go „didymem”, ponieważ wydawał się „nierozłącznym bratem bliźniakiem lantanu”. (2)
„Didym” został później wykazany w oddzielnych odkryciach jako mieszanina nieznanych pierwiastków ziem rzadkich. W 1879 roku Lecoq de Boisbaudran wykrył samar w didymie i oddzielił od niego samar. Carl Auer von Welsbach odkrył w 1885 r., Że pozostały „didym” był w rzeczywistości mieszaniną dwóch zupełnie nowych pierwiastków: neodymu i prazeodymu.


Lantan jest stosowany w niektórych produktach puli w celu obniżenia poziomu fosforanów w pokarmie glony.

Zgodnie z ruchem wskazówek zegara od środka od góry: tlenki ziem rzadkich prazeodymu, ceru, lantanu, neodymu, samaru i gadolinu. Zdjęcie: LLNL
Wygląd i charakterystyka
Szkodliwe skutki:
Lantan i jego związki są uważane za umiarkowanie toksyczne.
Charakterystyka:
Lantan to srebrzystobiały miękki metal, który można ciąć nożem.
Jest plastyczny , plastyczne i odsłonięte powierzchnie szybko matowieją w powietrzu tworząc tlenek.
Lantan reaguje z wodą, tworząc wodorotlenek lantanu i wodór.
Lantan jest chemicznie reaktywny i tworzy związki z węglem, azotem , boru, selenu, krzemu, fosforu, siarki i halogenów.
Lantan zwykle występuje w swoich związkach jako trójwartościowy jon La3 +.
Zastosowania lantanu
Lantan jest stosowany w dużych ilościach w akumulatorach niklowo-wodorkowych (NiMH) do samochodów hybrydowych. Elektroda ujemna (katoda) w akumulatorach NiMH jest mieszaniną wodorków metali – jednym z nich jest zazwyczaj wodorek lantanu. Materiałem aktywnym na katodzie jest wodór, który jest magazynowany w strukturze wodorku metalu. Wodorek metalu może, w zależności od swojego składu, zawierać od 1% do 7% wagowo wodoru. (3) Akumulator Toyoty Prius wymaga około 10 kg lantanu. (4)
Lantan jest stosowany jako katalizator krakingu ropy naftowej, katalizujący rozszczepianie węglowodorów o długim łańcuchu na związki o krótszych łańcuchach.
Lantan jest stosowany jako dodatek do produkcji żeliwa sferoidalnego i jako dodatek do stali.
Krzemienie zapalniczki wykorzystują metal miszący (stop ziem rzadkich) zawierający lantan do wytwarzania iskier przez tarcie.
Lantan jest stosowany w stopach gąbki wodorowej, która nawet 400 razy przekracza ich własny objętości wodoru.
Lantan jest również używany do produkcji gogli noktowizyjnych (szkła pochłaniającego podczerwień).
Wysokiej jakości soczewki aparatu i teleskopu zawierają tlenek lantanu (La2O3), wykorzystując ma wysoki współczynnik załamania światła i niską dyspersję.
Węglan lantanu jest stosowany w celu obniżenia poziomu fosforanów we krwi u pacjentów z chorobami nerek. (5)
Związki lantanu są również używane w niektórych produktach do basenów, aby zmniejszyć poziom składników odżywczych fosforanów, którymi żywią się glony.
Obfitość i izotopy
Obfitość skorupy ziemskiej: 34 części na milion wagowo, 5 części na milion moli
Obfitość Układu słonecznego: 2 części na miliard waga, 0,01 części na miliard na mole
Koszt, czysty: 800 USD za 100 g
Koszt, luz: za 100 g
Źródło: lantan nie jest wolny w naturze. Występuje głównie w minerałach monacyt i bastnezyt. W handlu odzyskuje się go z piasku monazytowego i bastnezytu przy użyciu różnych złożonych technik ekstrakcji. Czysty lantan uzyskuje się poprzez redukcję fluoru wapniem metalicznym.
Izotopy: lantan ma 31 izotopów, których okresy połowicznego rozpadu są znane, o liczbach masowych od 119 do 150. Jeden z nich jest stabilny, 139La. Naturalnie występujący lantan jest mieszaniną dwóch izotopów 138La i 139La o naturalnej zawartości odpowiednio 0,09% i 99,91%.

Cytuj tę stronę
Aby utworzyć łącze online, skopiuj i wklej jedno z następujących:
<a href="https://www.chemicool.com/elements/lanthanum.html">Lanthanum</a>
lub
<a href="https://www.chemicool.com/elements/lanthanum.html">Lanthanum Element Facts</a>
Aby zacytować tę stronę w dokumencie naukowym, użyj następującego cytatu zgodnego z MLA:
"Lanthanum." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/lanthanum.html>.