IJs drijft omdat het minder dicht is dan water. Water heeft een dichtheid van 1,0 g / kubieke cm.
De dichtheid van ijs Ih is 0,931 g / kubieke cm.
Maar waarom is ijs minder dicht dan water als beide zijn gemaakt op van H2O-moleculen?
————– > draai aan ——– > – spin off
—— > ruimte vullen / cpk ——– > stick —- > ball-and-stick
Het molecuul roteren — > Links klikken en slepen
Inzoomen – > > Links klikken + Shift ingedrukt houden knop en sleep verticaal
Jsmol Menu — > > Klik met de rechtermuisknop
Probeer dit!!
Verander eerst naar wireframe:
Klik met de rechtermuisknop op het vak
Stijl – > Schemas – – > wireframe
Labelatomen:
Stijl – > Label — > atoomnummer
Meet de volgende hoeken:
< 415
< 512
< 213
< 314
Om hoeken te meten: houd linkermuisknop boven atoom en dubbelklik op atoom 1, sleep naar tweede atoom (atoom midden) enkele klik midden atoom, sleep en dubbelklik atoom 3.
—— > space fill / cpk ——– > stick —- > ball-and-stick
Vloeibaar water heeft een gedeeltelijk geordende structuur waarin constant waterstofbruggen worden gevormd en breken.
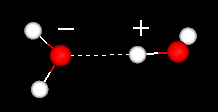
Aan de andere kant heeft ijs een stijve roosterstructuur.
In vloeibaar water is elk molecuul waterstof gebonden aan ongeveer 3,4 andere watermoleculen.
In ijs is elk molecuul waterstof gebonden aan 4 andere moleculen.
Vergelijk de twee structuren hieronder. Let op de lege ruimtes in de ijsstructuur.
 |
 |
In ijs vormt elk water vier waterstofbruggen met O — O afstanden van 2,76 Angstrom tot de dichtstbijzijnde zuurstofbuur. Vanwege de geordende structuur in ijs zijn er minder H20-moleculen in een gegeven volume-ruimte.
Probeer dit –
Probeer dit –
1) Meet de OO-afstanden tussen twee aangrenzende zuurstofatomen in ijs weergegeven in de bovenstaande structuur.
Voer uw antwoord in de daarvoor bestemde ruimte in:
In tegenstelling tot ijs – water op kamertemperatuur is constant in beweging – waterstofbruggen worden constant gevormd en verbroken – klik hier om watermoleculen in beweging te zien