Het chemische element lanthaan wordt geclassificeerd als een lanthanide en een zeldzaam aardmetaal. Het werd in 1839 ontdekt door Carl G. Mosander.

Data Zone
| Classificatie: | Lanthaan is een lanthanide en zeldzaam aardmetaal |
| Kleur: | zilverwit |
| Atoom gewicht: | 138.9055 |
| Staat: | vast |
| Smeltpunt : | 1540 oC, 1813,2 K |
| Kookpunt: | 2830 oC, 3103 K |
| Elektronen: | 57 |
| Protonen: | 57 |
| Neutronen in de meest voorkomende isotoop: | 82 |
| Elektronenschalen: | 2,8,18,18, 9,2 |
| Elektronenconfiguratie: | 5d1 6s2 |
| Dichtheid @ 20oC: | 6,16 g / cm3 |
Meer weergeven, inclusief: Heats, Energieën, Oxidatie,
Reacties , Compounds, Radii, Conductivities
| Atoomvolume: | 22,5 cm3 / mol |
| Structuur: | hcp: hexagonaal dicht opeengepakt |
| Hardheid: | 2,5 mohs |
| Specifieke warmtecapaciteit | 0,19 J g-1 K-1 |
| Smeltwarmte | 6,20 kJ mol-1 |
| Vernevelingswarmte | 414 kJ mol-1 |
| Warmte van verdamping | 400 kJ mol-1 |
| 1e ionisatie-energie | 538,1 kJ mol-1 |
| 2e ionisatie-energie | 1067 kJ mol-1 |
| 3e ionisatie-energie | 1850 kJ mol-1 |
| Elektronenaffiniteit | 50 kJ mol-1 |
| Minimum oxidatiegetal | 0 |
| Min. gemeenschappelijk oxidatienummer | 0 |
| Maximaal oxidatiegetal | 3 |
| Max. gemeenschappelijke oxidatie nr. | 3 |
| Elektronegativiteit (Pauling-schaal) | 1.1 |
| Polariseerbaarheid volume | 31,1 Å3 |
| Reactie met lucht | krachtig, met ht ⇒ La2O3 |
| Reactie met 15 M HNO3 | mild, ⇒ La (NO3) 3 |
| Reactie met 6 M HCl | mild, ⇒ H2, LaCl3 |
| Reactie met 6 M NaOH | geen |
| Oxide ( s) | La2O3 |
| Hydride (s) | LaH2, LaH3 |
| Chloride (n) | LaCl3 |
| Atoomradius | 195 pm |
| Ionische straal (1+ ion) | – |
| Ionische straal (2+ ion) | – |
| Ionische straal (3+ ion) | 117,2 uur |
| Ionische straal (1- ion) | – |
| Ionische straal (2- ion) | – |
| Ionisch straal (3- ion) | – |
| Thermische geleidbaarheid | 13,4 W m-1 K-1 |
| Elektrische geleidbaarheid | 1,9 x 106 S m-1 |
| Vries- / smeltpunt: | 1540 oC, 1813,2 K |

Lanthaan wordt gebruikt in veel toepassingen, zoals studioverlichting, laptopbatterijen, cameralenzen en hybride auto-accus.
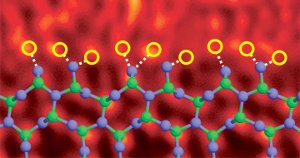
Siliciumnitride korrelgrens gedoteerd met lanthaanatomen. Afbeelding Ref. (6)
Ontdekking van lanthaan
Lanthaan werd in 1839 ontdekt door Carl G. Mosander in het mineraal ceriet in Stockholm, Zweden.
Ceriumoxide (ceriumoxide) was al in 1803 ontdekt door de Zweedse chemicus Jacob Berzelius in het mineraal ceriet. Mosander, die een van Berzelius leerlingen was geweest, vermoedde dat ceriumoxide een onzuiver oxide was dat andere zeldzame aarden bevatte. (1)
Mosander nam fijn verpoederd ceriumnitraat en voegde koud verdund salpeterzuur toe. Een deel van het ceriumnitraatpoeder is opgelost in het zuur, wat aangeeft dat er mogelijk een nieuwe aarde aanwezig is. Het nieuwe oxide was basischer dan ceriumoxide (ceriumoxide) en loste, in tegenstelling tot ceriumoxide, op in het zuur.
Mosander scheidde de oplossing van het neerslag met natriumoxalaat en warmte. Hij verkreeg een bleek baksteenkleurig oxide van de nieuwe zeldzame aarde. (1)
De naam lanthana voor het nieuwe oxide werd voorgesteld door zijn vriend Berzelius.
De naam komt van het Griekse woord lanthano dat verborgen is.
Axel Erdmann ontdekte onafhankelijk lanthaan in hetzelfde jaar als Mosander in een nieuw gevonden Noors mineraal. Erdmann noemde het nieuwe mineraal mosandriet, ter ere van Mosander.(2)
Mosander verkreeg onzuiver metallisch lanthaan uit het chloride. (1)
Zuiver lanthaanmetaal werd voor het eerst geproduceerd in 1923 door elektrolyse van de gesmolten halogeniden door H. Kremers en R. Stevens.
Mosander bleef lanthaan bestuderen en kondigde in 1841 de ontdekking aan. van een andere zeldzame aarde die erin zit. Hij noemde het ‘didymium’ omdat het een ‘onafscheidelijke tweelingbroer van lanthaan’ leek te zijn. (2)
‘Didymium’ werd later in afzonderlijke ontdekkingen aangetoond als een mengsel van onbekende zeldzame aardmetalen. In 1879 ontdekte Lecoq de Boisbaudran samarium in didymium en scheidde het samarium ervan. Carl Auer von Welsbach ontdekte in 1885 dat het overgebleven ‘didymium’ eigenlijk een mengeling was van twee geheel nieuwe elementen: neodymium en praseodymium.


Lanthaan wordt gebruikt in sommige zwembadproducten om het gehalte aan fosfaatvoedingsstoffen te verlagen algen.

Met de klok mee van boven in het midden: Zeldzame aardoxiden van praseodymium, cerium, lanthaan, neodymium, samarium en gadolinium. Foto: LLNL
Uiterlijk en kenmerken
Schadelijke effecten:
Lanthaan en zijn verbindingen worden als matig giftig beschouwd.
Kenmerken:
Lanthaan is een zilverwit zacht metaal dat met een mes kan worden gesneden.
Het is taai , vervormbare en blootliggende oppervlakken worden snel aangetast door lucht en vormen het oxide.
Lanthaan reageert met water om lanthaanhydroxide plus waterstofgas te vormen.
Lanthaan is chemisch reactief en vormt verbindingen met koolstof, stikstof , boor, seleen, silicium, fosfor, zwavel, en met de halogenen.
Lanthaan bestaat gewoonlijk als een driewaardig ion, La3 +, in zijn verbindingen.
Gebruik van lanthaan
Lanthaan wordt in grote hoeveelheden gebruikt in oplaadbare nikkel-metaalhydride (NiMH) -batterijen voor hybride autos. De negatieve elektrode (kathode) in NiMH-batterijen is een mengsel van metaalhydriden – een daarvan is typisch lanthaanhydride. Het actieve materiaal aan de kathode is waterstof, dat wordt opgeslagen in de metaalhydride-structuur. Het metaalhydride kan, afhankelijk van zijn samenstelling, tussen 1 en 7 gew.% Waterstof bevatten. (3) Een Toyota Prius-accu heeft ongeveer 10 kg lanthaan nodig. (4)
Lanthaan wordt gebruikt als katalysator voor het kraken van aardolie en katalyseert de splitsing van koolwaterstoffen met een lange keten in soorten met een kortere keten.
Lanthaan wordt gebruikt als een additief om nodulair gietijzer en als additief in staal.
Vlamaansteker vuurstenen gebruiken misch metaal (een zeldzame-aardelegering) dat lanthaan bevat om vonken te produceren door wrijving.
Lanthaan wordt gebruikt in waterstof-sponslegeringen, die tot 400 keer hun eigen legering in beslag nemen. hoeveelheid waterstofgas.
Lanthaan wordt ook gebruikt om nachtkijkers te maken (infrarood-absorberend glas).
Hoge kwaliteit camera- en telescooplenzen bevatten lanthaanoxide (La2O3) gebruikmakend van zijn hoge brekingsindex en lage dispersie.
Lanthaancarbonaat wordt gebruikt om het fosfaatgehalte in het bloed te verlagen bij patiënten met nieraandoeningen. (5)
Lanthaanverbindingen worden ook in sommige zwembadproducten gebruikt om het gehalte aan fosfaatvoedingsstoffen waarmee algen zich voeden, te verlagen.
Overvloed en isotopen
Overvloed aardkorst: 34 gewichtsdelen per miljoen, 5 delen per miljoen mol
Overvloed zonnestelsel: 2 delen per miljard per gewicht, 0,01 delen per miljard per mol
Kosten, puur: $ 800 per 100 g
Kosten, bulk: $ per 100 g
Bron: Lanthaan wordt niet gratis gevonden in de natuur. Het komt voornamelijk voor in de mineralen monaziet en bastnaesiet. Commercieel wordt het gewonnen uit monazietzand en bastnaesiet met behulp van verschillende complexe extractietechnieken. Zuiver lanthaan wordt verkregen door de reductie van fluoride met calciummetaal.
Isotopen: Lanthaan heeft 31 isotopen waarvan de halfwaardetijden bekend zijn, met massagetallen 119 tot 150. Hiervan is er één stabiel, 139La. Natuurlijk voorkomend lanthaan is een mengsel van de twee isotopen 138La en 139La met een natuurlijke abundantie van respectievelijk 0,09% en 99,91%.

Citeer deze pagina
Voor online linken, kopieer en plak een van de volgende:
<a href="https://www.chemicool.com/elements/lanthanum.html">Lanthanum</a>
of
<a href="https://www.chemicool.com/elements/lanthanum.html">Lanthanum Element Facts</a>
Gebruik de volgende MLA-compatibele bronvermelding om deze pagina in een academisch document te citeren:
"Lanthanum." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/lanthanum.html>.