De relatie tussen druk en volume: De wet van Boyle
Naarmate de druk op een gas toeneemt, neemt het volume van het gas af omdat de gasdeeltjes dichter bij elkaar worden gedrukt. Omgekeerd, als de druk op een gas afneemt, neemt het gasvolume toe omdat de gasdeeltjes kunnen nu verder uit elkaar bewegen. Weerballonnen worden groter naarmate ze door de atmosfeer stijgen naar gebieden met lagere druk, omdat het volume van het gas is toegenomen; dat wil zeggen, het atmosferische gas oefent minder druk uit op het oppervlak van de ballon, dus de inwendig gas zet uit totdat de interne en externe druk gelijk zijn.
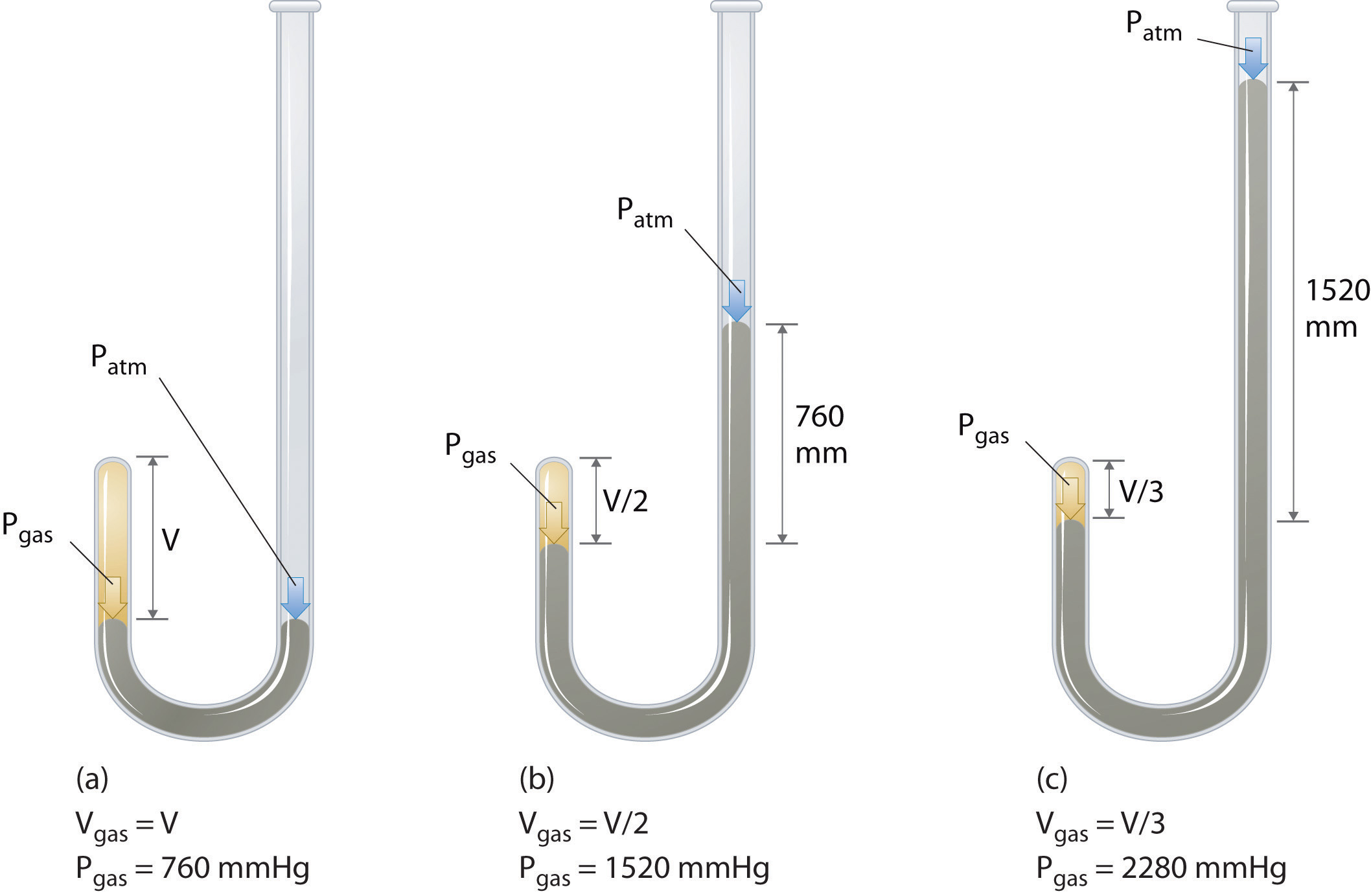
De Ierse chemicus Robert Boyle (1627-1691) voerde enkele van de vroegste experimenten uit die de kwantitatieve relatie tussen de druk en het volume van een gas. Boyle gebruikte een J-vormige buis die gedeeltelijk met kwik was gevuld, zoals weergegeven in figuur \ (\ PageIndex {1} \). Bij deze experimenten wordt een kleine hoeveelheid gas of lucht opgesloten boven de kwikkolom en het volume wordt gemeten bij atmosferische druk en constante temperatuur. Er wordt dan meer kwik in de open arm gegoten om de druk op het gasmonster te verhogen. De druk op het gas is de atmosferische druk plus het hoogteverschil van de kwikkolommen, en het resulterende volume wordt gemeten. Dit proces herhaalt zich totdat er ofwel geen ruimte meer is in de open arm of het gasvolume te klein is om nauwkeurig te meten. Gegevens zoals die van een van Boyles eigen experimenten kunnen op verschillende manieren worden geplot (Figuur \ (\ PageIndex {2} \)). Een eenvoudige plot van \ (V \) versus \ (P \) geeft een curve die een hyperbool wordt genoemd en onthult een omgekeerde relatie tussen druk en volume: als de druk wordt verdubbeld, neemt het volume af met een factor twee. Deze relatie tussen de twee grootheden wordt als volgt beschreven:
\
Beide zijden delen door \ (P \) geeft een vergelijking die de inverse relatie illustreert tussen \ (P \) en \ (V \):
\
of
\
waar het ∝-symbool wordt gelezen “is proportioneel met.” Een plot van V versus 1 / P is dus een rechte lijn waarvan de helling gelijk is aan de constante in Vergelijkingen \ (\ ref {10.3.1} \) en \ (\ ref {10.3.3} \). Beide zijden van Vergelijking \ (\ ref {10.3.1} \) door V in plaats van P geeft een vergelijkbare relatie tussen P en 1 / V. De numerieke waarde van de constante hangt af van de hoeveelheid gas die in het experiment wordt gebruikt en van de temperatuur waarbij de experimenten worden uitgevoerd. Deze relatie tussen druk en volume staat bekend als de wet van Boyle, naar de ontdekker ervan, en kan als volgt worden gezegd: bij constante temperatuur is het volume van een vaste hoeveelheid gas omgekeerd evenredig met de druk. wet in de praktijk wordt weergegeven in Figuur \ (\ PageIndex {2} \).
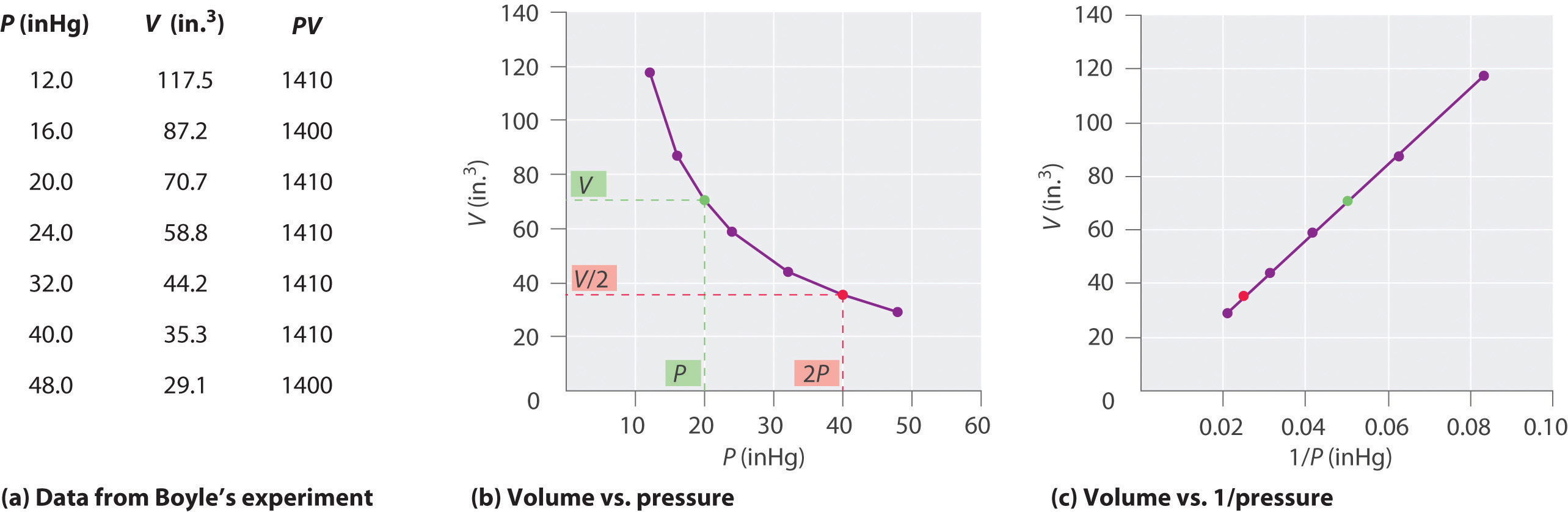
Bij constante temperatuur is het volume van een vaste hoeveelheid gas omgekeerd evenredig met de druk