Empirisk bevis klargjør risikofaktorer, årsaker og førstelinjeintervensjoner.
Jeffrey R. Strawn, MD – klinisk instruktør i psykiatri, avdeling for psykiatri, University of Cincinnati College of Medicine
Paul E. Keck Jr, MD
professor i psykiatri, avdeling for psykiatri, University of Cincinnati College of Medicine, president og administrerende direktør, Lindner Center of HOPE, Cincinnati, OH
Stanley N. Caroff, MD
Professor i psykiatri, avdeling for psykiatri, University of Pennsylvania School of Medicine, sjef for pasientpsykiatri, psykiatritjeneste, Philadelphia VA Medical Center
Diagnose og behandling av malignt neuroleptisk syndrom (NMS) er kontroversielt fordi dette potensielt livstruende syndromet er sjeldent og presentasjonen varierer. Disse faktorene gjør det vanskelig å evaluere behandlinger i kontrollerte kliniske studier, og data om den relative effekten av spesifikke inngrep er knappe. Det kan imidlertid være mulig å utvikle rasjonelle retningslinjer for behandling ved hjelp av empiriske kliniske data.1,2
Denne artikkelen undersøker bevisene knyttet til 6 kontroversielle aspekter ved NMS-diagnose og behandling:
• mest pålitelige risikofaktorer
• NMS som en spektrumforstyrrelse
• hva som forårsaker NMS
• NMS utløst av første generasjon mot andre generasjons antipsykotika
• førstelinjeintervensjoner
• omstart av antipsykotika etter en NMS-episode.
ER DET PÅLITELIGE RISIKOFAKTORER FOR NMS?
I små case-kontrollerte studier var agitasjon, dehydrering og utmattelse de mest konsekvent funnet systemiske faktorene som antas å disponere pasienter som tar antipsykotika til NMS (tabell 1) .3-5 Catatonia og organiske hjernesyndrom kan være separate risikofaktorer.1,6
Foreløpige studier har også implisert dopaminreseptoravvik forårsaket av genetiske polymorfier eller effekter av lavt serumjern.1,7, 8 Farmakologiske studier har antydet at høyere doser, rask titrering og IM-injeksjoner av antipsykotika er assosiert med økt NMS-risiko.3,5 Noen studier antyder at 15% til 20% av NMS-pasientene tidligere har hatt NMS-episoder. 1,2 I tillegg har førstegenerasjons antipsykotika (FGA) med høy styrke – spesielt haloperidol – antas å ha høyere risiko enn medisiner med lav styrke og andre generasjons antipsykotika (SGA), selv om denne hypotesen fortsatt er vanskelig å bevise. 9-11
Disse risikofaktorene er imidlertid ikke praktiske for å estimere NMS-risiko hos en gitt pasient fordi de er relativt vanlige sammenlignet med lav risiko for NMS-forekomst. For de aller fleste pasienter med psykotiske symptomer vil fordelene med riktig indikert antipsykotisk farmakoterapi oppveie risikoen.
Tabell 1 Hva øker NMS-risikoen?
- Agitasjon
- Dehydrering
- Utmattelse
- Lav serumjernkonsentrasjon (normal: 60 til 170 mcg / dL)
Diagnoser
- Historie av NMS
- Catatonia
- Organiske hjernesyndrom
Sentralnervesystemet
- Dopaminreseptor dysfunksjon
- Dysfunksjon i basale ganglier
- Dysfunksjon i det sympatiske nervesystemet
Farmakologisk behandling *
- Intramuskulære eller intravenøse injeksjoner
- Dopaminantagonister med høy styrke
- Rask dosetitrering
- Høye doser
- FGAs sammenlignet med SGAs (?)
* For enkeltpasienter må disse vanlige risikofaktorene veies på nytt fordelene med antipsykotisk behandling
FGAs: først generasjons antipsykotika;
SGA: andre generasjons antipsykotika; NMS: malignt neuroleptisk syndrom
Kilde: Referanser 1-5
ER NMS RELATERT TIL PARKINSONISM, KATATONIA ELLER MALIGNANT HYPERTERMIA?
Parkinsonisme. Noen forskere har beskrevet NMS som en ekstrem parkinsonkrise som følge av overveldende blokade av dopaminveier i hjernen.1,2,12 I denne oppfatningen ligner NMS det parkinson-hypertermi syndromet som kan oppstå hos pasienter med Parkinsons sykdom etter brå seponering eller tap av effekten av dopaminerg terapi, som kan behandles ved å gjeninnsette dopaminerge midler.13 Bevis som støtter dette synspunktet inkluderer:
• Parkinsons tegn er en hovedtrekk ved NMS.
• Tilbaketrekking av dopaminagonister utfeller syndromet.
• Alle utløsende medikamenter er dopaminreseptorantagonister.
• NMS-risiko korrelerer med stoffers dopaminreseptoraffinitet.
• Dopaminerge agonister kan være en effektiv behandling.
• Lesjoner i dopaminerge veier gir et lignende syndrom.
• Pasienter med NMS har vist lave cerebrospinalvæskekonsentrasjoner av dopaminmetabolitten homovanillinsyre.14
Catatonia. Fink et al15 og andre16-18 har overbevisende hevdet at NMS representerer en form for legemiddelindusert ondartet kataton. Bevis som støtter dette inkluderer:
• De to lidelsene deler nevropsykiatriske symptomer.
• Katatoniske tegn er vanlige i NMS.19
• Malign katatoni og NMS deler fysiologiske tegn og laboratorietegn.20
• Gjeninnføring av antipsykotika kan forverre begge tilstandene akutt.
• Benzodiazepiner og elektrokonvulsiv behandling (ECT) ) er effektive behandlinger for begge lidelsene. 15-18
Lee21 undersøkte sammenhengen mellom katatoniske egenskaper og behandlingsrespons hos 14 NMS-pasienter. De fleste pasienter med katatoniske symptomer reagerte på benzodiazepiner, mens ingen av dem hadde en ekstrapyramidal-hypertermisk presentasjon uten kataton. Lee konkluderte med at NMS er heterogent og kan forekomme i katatoniske og ikke-katatoniske former som avviker i behandlingsrespons.
Malign hypertermi. Noen klinikere har sammenlignet NMS med ondartet hypertermi forårsaket av inhalasjonsanestetika og suksinylkolin.1,2 Bevis inkluderer:
• lignende kliniske tegn på stivhet, hypertermi og hypermetabolisme
• lignende fysiologiske tegn og laboratorietegn, slik som rabdomyolyse
• hypertermi hos begge som reagerer på dantrolen.
Selv om de to er like i presentasjon, oppstår ondartet hypertermi intraoperativt og reflekterer en farmakogenetisk forstyrrelse av kalsiumregulering i skjelettmuskulaturen. I tillegg reagerer stivhet i ondartet hypertermi ikke på perifertvirkende muskelavslappende midler.1,22 Bevis tyder på at pasienter som tidligere har opplevd en NMS-episode ikke har noen risiko for ondartet hypertermi.22
HVA ER PATFYSYSIOLOGIEN OF NMS?
NMS patofysiologi er kompleks og involverer sannsynligvis samspill mellom flere sentrale og systemiske veier og nevrotransmittere. Som beskrevet ovenfor antyder overbevisende bevis at dopaminblokkade spiller en sentral rolle. 12
Dopaminblokkade i hypothalamus antas å bidra til termoreguleringssvikt, og blokkering i nigrostriatal-systemet bidrar sannsynligvis til muskelstivhet og hypermetabolisme. Tapet av dopaminergisk inngang til den fremre cingulate-mediale orbitofrontale kretsen og den laterale orbitofrontale kretsen bidrar sannsynligvis til de mentale statusendringene og katatoniske trekk sett i NMS. 12
Noen forskere har imidlertid foreslått konkurrerende eller komplementære hypoteser. For eksempel foreslo Gurrera 23 at pasienter som er utsatt for å utvikle NMS, har en sårbarhet overfor et hyperaktivt og dysregulert sympatisk nervesystem, og denne egenskapen – sammen med dopaminsystemforstyrrelser indusert av dopaminblokkerende midler – produserer NMS. Andre etterforskere har implisert serotonin, noradrenalin, gamma-aminosmørsyre og glutaminerge mekanismer. 1,12,24,25
ER FGAS ELLER SGAS MER LIKELIG FOR Å FORÅRSAKE NMS?
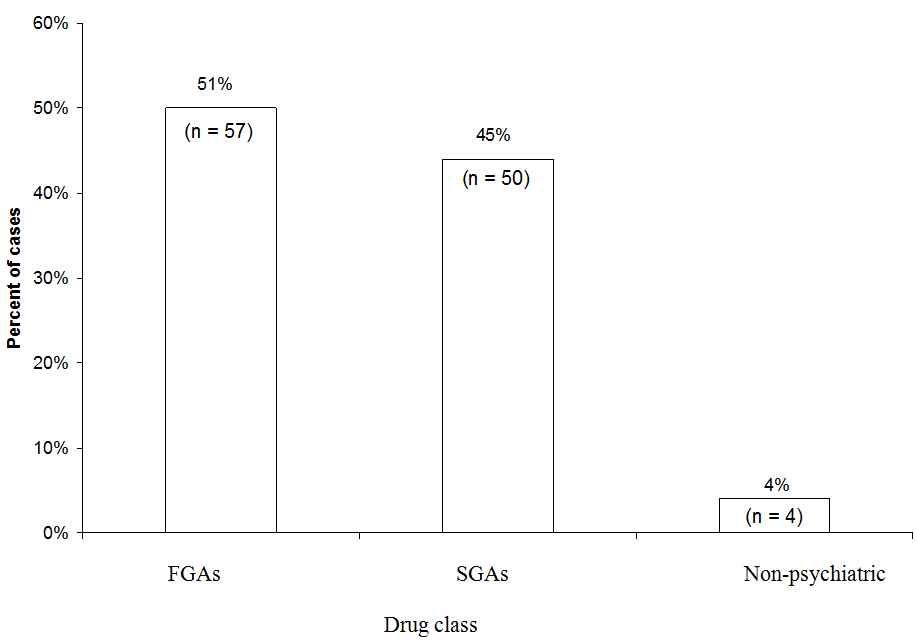
FGA: Første generasjons antipsykotisk
SGA: Andegenerasjons antipsykotisk
Litt flere NMS-tilfeller ble tilskrevet FGA (51%) enn SGA (45%) i en analyse av 111 tilfeller av sannsynlig eller bestemt NMS assosiert med et enkelt medikament rapportert til NMS Hotline fra 1997 til 2006. FGA-haloperidol utgjorde 44% av alle tilfeller. «Medisinsk» refererer til tilfeller der en neuroleptiker ble brukt i et ikke-psykiatrisk miljø.
Kilde: Ikke-publiserte data registrert hos Neuroleptic Malignant Syndrome Information Service.
NMS antas å forekomme sjeldnere hos pasienter behandlet med SGA enn hos de som mottok FGA, selv om denne hypotesen er uprøvd. Isolerte rapporter om NMS har blitt assosiert med nesten alle SGA.9-11 Det er vanskelig å bevise FGA mot SGA-forpliktelser fordi:
• NMS er sjelden.
• Doseringspraksis kan være mer konservativ nå enn tidligere.
• De fleste klinikere er klar over de tidlige tegn på NMS.
I en epidemiologisk studie av en stor database fant Stubner et al 26 at pasienter som fikk SGA hadde en lavere risiko for NMS enn de som ble behandlet med haloperidol. 26 I denne studien var den totale frekvensen av NMS 0,02%.
NMS-hotline-data. Vi har nylig undersøkt hvilke medisineringsklasser som var implisert i 111 NMS-tilfeller rapportert til Neuroleptic Malignant S yndrome Information Service hotline (1-888-NMSTEMP) mellom 1997 og 2006 (figur). Vi inkluderte bare tilfeller av bestemt eller sannsynlig NMS (som diagnostisert av hotline-konsulenter) der et enkelt antipsykotisk middel ble administrert. Litt flere tilfeller ble tilskrevet FGA-er (51%) enn SGA-er (45%). De resterende tilfellene ble tilskrevet neuroleptika som ble brukt i medisinske omgivelser (som prometazin eller proklorperazin).
Fordi de nå foreskrives sjeldnere, utgjorde FGAs et uforholdsmessig antall NMS-tilfeller rapportert til hotline. Haloperidol utgjorde flertallet av FGA-saker og 44% av alle tilfeller. Hvis vi hadde ekskludert haloperidol og sammenlignet NMS-risikoen for SGA-er med bare mellom- eller lav-potens FGA-er, ville den relative fordelen med SGA-er gått tapt. På den annen side er det klart at SGA fortsatt har en risiko for NMS.
Analyser antyder at de SGA-assosierte klassiske trekk ved NMS – feber, muskelstivhet og endringer i autonom og mental status – beholdes hos pasienter som får SGA, selv om noen kanskje ikke utvikler den alvorlige stivheten og ekstreme temperaturene som er vanlige hos pasienter som får FGA. .9-11 De mildere kliniske egenskapene forbundet med SGA-er kan gjenspeile mer konservative forskrivningsmønstre eller økt bevissthet og tidligere anerkjennelse av NMS, noe som ville forhindre fulminante presentasjoner.
HVA ER BEVISEN FOR SPESIFIKE NMS-BEHANDLINGER?
NMS er sjelden, presentasjonen varierer og progresjonen er uforutsigbar. Disse faktorene gjør det vanskelig å evaluere behandlinger i kontrollerte kliniske studier, og data om den relative effekten av spesifikke intervensjoner er knappe.
Allikevel antyder forestillingen om at NMS representerer en ekstrem variant av medikamentindusert parkinsonisme eller katatoni at spesifikk NMS behandlinger kan være basert på symptomets alvorlighetsgrad eller presentasjonsstadium. Vi foreslår en behandlingsretningslinje basert på teoretiske mekanismer og anekdotiske data.2,27-29
Støtte. Etter øyeblikkelig seponering av den krenkende medisinen, er støttende terapi hjørnesteinen i NMS-behandling.1,2,27
For pasienter som har milde tegn og symptomer, kan støttende pleie og nøye klinisk overvåking være tilstrekkelig. Ekstrem hypertermi krever tiltak for volumgjenopplivning og avkjøling, intensiv medisinsk behandling og nøye overvåking av komplikasjoner.
Behandling. Til tross for mangel på enighet om medikamentell behandling for ukomplisert NMS, får omtrent 40% av pasientene med akutt NMS farmakologiske behandlinger.2
Lorazepam, 1 til 2 mg parenteralt, er en rimelig førstelinjebehandling for NMS, spesielt hos personer med katatoniske trekk.4,15-18,21,30,31 Noen etterforskere anbefaler høyere doser.15 Benzodiazepiner foretrekkes hvis sedasjon er nødvendig hos agiterte NMS-pasienter.4,15-18
Dopaminerge midler som bromokriptin og amantadin forbedrer dopaminerge overføring for å reversere parkinsonsymptomer og har blitt rapportert å redusere tiden til restitusjon og halvere dødeligheten når den brukes alene eller sammen med andre behandlinger.13,27,32,33 Rask seponering av disse midlene kan resultere i reboundsymptomer, selv om dette kan være sant for enhver spesifikk medikamentell behandling av NMS.1,31,32
Dantrolene kobler ut eksitasjon-sammentrekningskobling ved å forbedre kalsiumbindingen i sarkoplasmatisk retikulum i skjelettmuskulaturen og har vært oss ed for å behandle NMS hypermetabolske symptomer. Noen vurderinger fant forbedring hos opptil 80% av NMS-pasienter behandlet med dantrolen-monoterapi. 27,32-35 Sammenlignet med støttende pleie kan tiden til bedring reduseres – og dødeligheten reduseres med nesten halvparten – når dantrolen brukes alene eller i kombinasjon med andre medisiner.
Ikke alle saksrapporter har vist at dantrolen, benzodiazepiner eller dopaminerge agonister er effektive i behandling av NMS.31,36 Etter vår mening er bare avanserte NMS-tilfeller – med ekstreme temperaturøkninger, alvorlige stivhet, og bevis for systemisk hypermetabolisme – nytte av behandling med dantrolen.1,2
ECT har blitt brukt med suksess for å redusere dødeligheten fra NMS og andre kataton-spektrumforstyrrelser. Det brukes vanligvis etter støttende terapi og psykofarmakologiske inngrep mislykkes. 2,15,16,27,37 ECT for akutt NMS består vanligvis av en serie på 6 til 10 behandlinger med bilateral elektrodeplassering. Daglig ECT kan være nødvendig i utgangspunktet.15
ER ANTIPSYKOTISK KONTRAINDIKERT FØLGENDE EN NMS-EPISODE?
NMS-tilbakefallshastigheten ved gjenbehandling med et antipsykotisk middel har variert.38 Vi estimerer at opptil 30 % av pasientene kan ha en risiko for NMS-tilbakefall når de utfordres med et antipsykotisk middel.1 Ved å følge riktige forholdsregler (tabell 2) kan du imidlertid trygt behandle de fleste pasienter som trenger fortsatt antipsykotisk behandling.1,2
Når du starter behandlingen på nytt , kan et antipsykotisk middel med lavere potens fra en annen kjemisk klasse være et tryggere alternativ enn å prøve utløsermidlet på nytt, ifølge retrospektive analyser av begrensede tilgjengelige data. En pasient som utvikler NMS på en FGA, kan ha nytte av en SGA-prøve, selv om det er en viss risiko for tilbakefall.1,10
Tabell 2Gjeninnføre antipsykotika etter en NMS-episode
Kontroller nøyaktigheten av diagnosen for en tidligere NMS-episode
Dokumentindikasjoner for antipsykotiske medisiner
Diskuter risiko og fordeler, inkludert risiko for gjentakelse, med pasient og familie
Vurder alternative farmakologiske midler
Minimer risikofaktorer (tabell 1)
Tillat ≥2 uker (≥4 uker for langtidsvirkende injiserbar medisinering) etter at en NMS-episode er løst før du utfordrer
Velg FGA-er eller SGA-er med lav styrke
Foreskrive en initial testdose
Overvåke vitale tegn og nevrologisk status
Titrat doser gradvis
FGA: første generasjons antipsykotika;
SGA: andre generasjons antipsykotika
Kilde: Referanser 1,2
Relaterte ressurser
• Informasjonstjeneste for neuroleptisk malignt syndrom. www.nmsis.org.
• Zarrouf FA, Bhanot V. Neuroleptisk ondartet syndrom: ikke la din vakt være nede ennå. Nåværende psykiatri 2007; 6 (8): 89-95.
Merkenavn for legemidler
Amantadine • Symmetrel
bromokriptin • Parlodel
klorpromazin • Thorazine
Dantrolene Dantrium®
flufenazin • Prolixin
Haloperidol • Haldol
Lorazepam • Ativan
Loxapine • Loxitane
Perphenazine • Trilafon
Prochlorperazine • Compazine, Compro
Promethazine • Phenergan
Thioridazine • Mellaril
Utlevering
Dr. Strawn er et amerikansk psykiatrisk institutt for forskning og utdanning (APIRE) / Janssen Scholar.
Dr. Keck har mottatt forskningsstøtte fra eller fungert som konsulent for Abbott Laboratories, American Diabetes Association, AstraZeneca Pharmaceuticals, Bristol-Myers Squibb, GlaxoSmithKline, Eli Lilly and Company, Janssen Pharmaceutica, National Institute of Mental Health, National Institute of Drug Abuse, Pfizer , Stanley Medical Research Institute, og UCB Pharma.
Dr. Caroff har mottatt forskningsstøtte fra Bristol-Myers Squibb, Ortho-McNeil Neurologics og Pfizer.
- Caroff SN. Malignt neuroleptisk syndrom. I: Mann SC, Caroff SN, Keck PE Jr, Lazarus A, red. Malignt neuroleptisk syndrom og relaterte tilstander 2. utg. Washington, DC: American Psychiatric Publishing Inc; 2003; 1-44.
- Strawn JR, Keck PE Jr, Caroff SN. Neuroleptisk ondartet syndrom Am J Psychiatry 2007; 164: 870–6.
- Keck PE Jr, Pope HG Jr, Cohen BM, et al. Risikofaktorer for malignt neuroleptisk syndrom Arch Gen Psychiatry 1989; 46: 914–18.
- Rosebush PI, Stewart TD. En prospektiv analyse av 24 episoder av malignt neuroleptisk syndrom Am J Psychiatry 1989; 146: 717-25.
- Berardi D, Amore M, Keck PE Jr, et al. Kliniske og farmakologiske risikofaktorer for ondartet neuroleptisk syndrom: en case-control studie. Biol Psychiatry 1998; 44: 748–54.
- White DA, Robins AH. Catatonia: forkynner av neuroleptisk ondartet syndrom Br J Psychiatry 1991; 158: 419-21.
- Rosebush PI, Mazurek MF. Serumjern og nevroleptisk ondartet syndrom. Lancet 1991; 338: 149–51.
- Lee JW. Serumjern i kataton og malignt neuroleptisk syndrom Biol Psychiatry 1998; 44: 499–507.
- Ananth J, Parameswaran S, Gunatilake S, et al. Malignt neuroleptisk syndrom og atypiske antipsykotiske medikamenter J Clin Psychiatry 2004; 65: 464–70.
- Caroff SN, Mann SC, Campbell EC. Atypiske antipsykotika og nevroleptisk ondartet syndrom Psychiatr Ann 2000; 30: 314–21.
- Hasan S, Buckley P. Nye antipsykotika og nevroleptisk ondartet syndrom Am J Psychiatry 1998; 155: 1113–16.
- Mann SC, Caroff SN, Fricchione G, Campbell EC. Sentral dopaminhypoaktivitet og patogenesen av neuroleptisk ondartet syndrom Psychiatr Ann 2000; 30: 363–74.
- Factor SA, Santiago A. Parkinsonism-hyperpyrexia syndrom i Parkinsons sykdom. I: Frucht SJ, Fahn S, red. . Bevegelsesforstyrrelsessituasjoner: diagnose og behandling. Totowa, NJ: Humana Press; 2005; 29-40.
- Nisijima K, Ishiguro T. Cerebrospinalvæskenivåer av monoaminmetabolitter og gamma-aminosmørsyre i neuroleptisk ondartet syndrom. J Psychiatr Res 1995; 27: 233–44.
- Fink M, Taylor MA. Malignt neuroleptisk syndrom er ondartet katatoni, noe som garanterer behandling som er effektiv for kataton. Prog Neuropsychopharmacol Biol Psychiatry 2006; 30: 1182–3.
- Fricchione G, Bush G, Fozdar M, et al. Anerkjennelse og behandling av katatonisk syndrom. J Intensive Care Med 1997; 12: 135–47.
- Philbrick KL, Rummans TA. Malign katatoni. J Neuropsychiatry Clin Neurosci 1994; 6: 1–13.
- Mann SC, Caroff SN, Bleier HR, et al. Dødelig kataton. Am J Psychiatry 1986; 143: 1374–81.
- Koch M, Chandragiri S, Rizvi S, et al. Katatoniske tegn i nevroleptisk ondartet syndrom. Compr Psychiatry 2000; 41: 73–5.
- Lee JW. Laboratoriefunn. I: Caroff SN, Mann SC, Francis A, Fricchoine GL, red. Catatonia: fra psykopatologi til nevrobiologi Washington, DC: American Psychiatric Press, Inc; 2004; 65-75.
- Lee JW.Katatoniske varianter, hypertermiske ekstrapyramidale reaksjoner og undertyper av malignt neuroleptisk syndrom. Ann Clin Psychiatry 2007; 19: 9–16.
- Caroff SN, Rosenberg H, Mann SC, et al. Neuroleptisk ondartet syndrom i perioperativ setting. Am J Anesthesiol 2001; 28: 387–93.
- Gurrera RJ. Sympathoadrenal hyperaktivitet og etiologien til malignt neuroleptisk syndrom. Am J Psychiatry 1999; 156: 169–80.
- Carroll BT. Den universelle felthypotesen om kataton og malignt neuroleptisk syndrom. CNS Spectr 2000; 5: 26–33.
- Weller M, Kornhuber J. En begrunnelse for terapi av NMDA-reseptorantagonister av malignt neuroleptisk syndrom. Med Hypoteser 1992; 38: 329–33.
- Stubner S, Rustenbeck E, Grohmann R, et al. Alvorlige og uvanlige ufrivillige bevegelsesforstyrrelser på grunn av psykofarmaka. Farmakopsykiatri 2004; 37 (suppl 1): S54 – S64.
- Davis JM, Caroff SN, Mann SC. Behandling av ondartet neuroleptisk syndrom. Psychiatr Ann 2000; 30: 325–31.
- Adityanjee PA, Singh S, Singh G, Ong S. Spectrum concept of malignant neuroleptic syndrome. Br J Psychiatry 1988; 153: 107–11.
- Woodbury MM, Woodbury MA. Nevroleptisk indusert katatoni som et stadium i utviklingen mot malignt neuroleptisk syndrom. J Am Acad Child Adolesc Psychiatry 1992; 31: 1161–4.
- Francis A, Chondragivi S, Rizvi S, et al. Er lorazepam en behandling for ondartet neuroleptisk syndrom? CNS Spectr 2000; 5: 54–7.
- Rosebush PI, Stewart T, Mazurek MF. Behandling av malignt neuroleptisk syndrom. Er dantrolen og bromokriptin nyttige tilsetningsstoffer for støttende pleie? Br J Psychiatry 1991; 159: 709–12.
- Sakkas P, Davis JM, Janicak PG, Wang ZY. Medikamentell behandling av malignt neuroleptisk syndrom. Psychopharmacol Bull 1991; 27: 381–4.
- Rosenberg MR, Green M. Neuroleptisk malignt syndrom: gjennomgang av respons på terapi. Arch Intern Med 1989; 149: 1927–31.
- Yamawaki S, Morio M, Kazamutsuri G, et al. Klinisk evaluering og effektiv bruk av dantrolennatrium i malignt neuroleptisk syndrom. Kiso to Rinsyou (Clinical Reports) 1993; 27: 1045–66.
- Tsutsumi Y, Yamamoto K, Matsuura S, et al. Behandling av nevroleptisk ondartet syndrom ved bruk av dantrolennatrium. Psychiatry Clin Neurosci 1998; 52: 433–8.
- Reulbach U, Dutsch C, Biermann T, et al. Behandle en effektiv behandling for malignt neuroleptisk syndrom. Crit Care 2007; 11: R4.
- Troller JN, Sachdev PS. Elektrokonvulsiv behandling av malignt neuroleptisk syndrom: en gjennomgang og rapportering av tilfeller. Aust N Z J Psychiatry 1999; 33: 650–9.
- Pave HG, Aizley HG, Keck PE Jr, McElroy SL. Neuroleptisk malignt syndrom: langsiktig oppfølging av 20 tilfeller. J Clin Psychiatry 1991; 52: 208-12.