Det kjemiske elementet lanthanum er klassifisert som et lantanid og sjeldne jordartsmetaller. Den ble oppdaget i 1839 av Carl G. Mosander.

Datasone
| Klassifisering: | Lanthanum er et lantanid og sjeldne jordartsmetaller |
| Farge: | sølvhvitt |
| Atomic vekt: | 138.9055 |
| Tilstand: | solid |
| Smeltepunkt : | 1540 oC, 1813,2 K |
| Kokepunkt: | 2830 oC, 3103 K |
| Elektroner: | 57 |
| Protoner: | 57 |
| Nøytroner i mest isotop: | 82 |
| Elektronskall: | 2,8,18,18, 9,2 |
| Elektronkonfigurasjon: | 5d1 6s2 |
| Tetthet @ 20oC: | 6,16 g / cm3 |
Vis mer, inkludert: Heats, Energies, Oxidation,
Reaksjoner , Compounds, Radii, Conductivities
| Atomvolum: | 22,5 cm3 / mol |
| Struktur: | hcp: sekskantet tettpakket |
| Hardhet: | 2,5 mohs |
| Spesifikk varmekapasitet | 0,19 J g-1 K-1 |
| Fusjonsvarme | 6,20 kJ mol-1 |
| Forstøvningsvarme | 414 kJ mol-1 |
| Varme av fordampning | 400 kJ mol-1 |
| 1. ioniseringsenergi | 538,1 kJ mol-1 |
| 2. ioniseringsenergi | 1067 kJ mol-1 |
| 3. ioniseringsenergi | 1850 kJ mol-1 |
| Elektronaffinitet | 50 kJ mol-1 |
| Minimum oksidasjonsnummer | 0 |
| Min. vanlig oksidasjonsnummer. | 0 |
| Maksimalt oksidasjonsnummer | 3 |
| Maks. vanlig oksidasjon nr. | 3 |
| Elektronegativitet (Pauling Scale) | 1.1 |
| Polariserbarhet volum | 31.1 Å3 |
| Reaksjon med luft | kraftig, m / ht ⇒ La2O3 |
| Reaksjon med 15 M HNO3 | mild, ⇒ La (NO3) 3 |
| Reaksjon med 6 M HC1 | mild, ⇒ H2, LaCl3 |
| Reaksjon med 6 M NaOH | ingen |
| Oksid ( s) | La2O3 |
| Hydride (s) | LaH2, LaH3 |
| Klorid (er) | LaCl3 |
| Atomeradius | 195 pm |
| Ionic radius (1+ ion) | – |
| Ionic radius (2+ ion) | – |
| Ionic radius (3+ ion) | 117.2 pm |
| Ionic radius (1- ion) | – |
| Ionic radius (2- ion) | – |
| Ionic radius (3- ion) | – |
| Varmeledningsevne | 13,4 W m-1 K-1 |
| Elektrisk ledningsevne | 1,9 x 106 S m-1 |
| Frysepunkt / smeltepunkt: | 1540 oC, 1813,2 K |

Lanthanum brukes i mange applikasjoner, for eksempel studiobelysning, bærbare batterier, kameralinser og hybridbatterier.
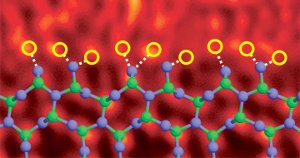
Silikonitridkorngrense dopet med lantanatomer. Bilde Ref. (6)
Discovery of Lanthanum
Lanthanum ble oppdaget i 1839 av Carl G. Mosander i mineralet cerite i Stockholm, Sverige.
Ceria (ceriumoxide) hadde allerede blitt oppdaget i 1803 av svensk kjemiker Jacob Berzelius i mineral ceriet. Mosander, som hadde vært en av Berzelius studenter, mistenkte at ceria var et urent oksid som inneholder andre sjeldne jordarter. (1)
Mosander tok fint pulverisert ceriumnitrat og tilsatte kald fortynnet salpetersyre. Noe av ceriumnitratpulveret oppløst i syren, noe som indikerer at en ny jord kan være til stede. Det nye oksidet var mer basisk enn cerium (ceriumoksid) og, i motsetning til ceria, oppløst i syren.
Mosander separerte løsningen fra bunnfallet ved bruk av natriumoksalat og varme. Han fikk et blekt mursteinfarget oksid av den nye sjeldne jorden. (1)
Navnet lanthana for det nye oksidet ble foreslått av hans venn Berzelius.
Navnet kommer fra det greske ordet «lanthano» som betyr å være skjult.
Axel Erdmann oppdaget lanthanum uavhengig samme år som Mosander i et nylig funnet norsk mineral. Erdmann kalte det nye mineralet mosandrite, til ære for Mosander.(2)
Mosander fikk urent metallisk lantan fra kloridet. (1)
Rent lantanmetall ble først produsert i 1923 ved elektrolyse av de smeltede halidene av H. Kremers og R. Stevens.
Mosander fortsatte å studere lanthana og i 1841 kunngjorde oppdagelsen av en annen sjelden jord som den inneholder. Han kalte det ‘didymium’ fordi det så ut til å være ‘en uatskillelig tvillingbror til lanthanum.’ (2)
‘Didymium’ ble senere vist i separate funn å være en blanding av ukjente sjeldne jordelementer. I 1879 oppdaget Lecoq de Boisbaudran samarium i didymium og skilte samarium fra det. Carl Auer von Welsbach oppdaget i 1885 at det gjenværende ‘didymium’ egentlig var en blanding av to helt nye elementer: neodym og praseodym.


Lanthanum brukes i noen bassengprodukter for å redusere nivået av fosfatnæringsstoffer som fôrer alger.

Med urviseren fra toppsenter: Sjeldne jordoksider av praseodym, cerium, lanthanum, neodym, samarium og gadolinium. Foto: LLNL
Utseende og egenskaper
Skadelige effekter:
Lanthanum og dets forbindelser anses å være moderat giftig.
Egenskaper:
Lanthanum er et sølvhvitt mykt metall som kan kuttes med en kniv.
Det er duktilt formbare og eksponerte overflater sverter raskt i luft som danner oksidet.
Lantan reagerer med vann og danner lantanhydroksid pluss hydrogengass.
Lantan er kjemisk reaktivt og danner forbindelser med karbon, nitrogen , bor, selen, silisium, fosfor, svovel og med halogenene.
Lantan eksisterer vanligvis som et treverdig ion, La3 +, i forbindelsene.
Bruk av lanthanum
Lanthanum brukes i store mengder i nikkelmetallhydrid (NiMH) oppladbare batterier for hybridbiler. Den negative elektroden (katoden) i NiMH-batterier er en blanding av metallhydrider – den ene er vanligvis lantanhydrid. Det aktive materialet ved katoden er hydrogen, som lagres i metallhydridstrukturen. Avhengig av sammensetningen kan metallhydridet inneholde mellom 1 og 7 vekt% hydrogen. (3) Et Toyota Prius-batteri krever omtrent 10 kg lantan. (4)
Lanthanum brukes som en petroleumssprengningskatalysator, som katalyserer splitting av langkjedede hydrokarboner til kortere kjedede arter.
Lanthanum brukes som tilsetningsstoff for å lage nodulært støpejern og som tilsetningsstoff i stål.
Flammelysere bruker flammemetall (en sjelden jordlegering) som inneholder lantan for å produsere gnister ved friksjon.
Lantan brukes i hydrogensvamplegeringer, som tar opptil 400 ganger sin egen volum av hydrogengass.
Lanthanum brukes også til å lage nattsynsbriller (infrarødtabsorberende glass).
Kameraer og teleskoplinser av høy kvalitet inneholder lantanoksid (La2O3) som bruker dens høye brytningsindeks og lave spredning.
Lantankarbonat brukes til å redusere blodnivået av fosfat hos pasienter med nyresykdom. (5)
Lantanforbindelser brukes også i noen bassengprodukter for å redusere nivået av fosfatnæringsstoffer som alger lever av.
overflod og isotoper
overflod jordskorpe: 34 vektdeler per million, 5 deler per million mol.
overflod solsystem: 2 deler per milliard ved vekt, 0,01 deler per milliard mol.
Kostnad, ren: $ 800 per 100g
Kostnad, bulk: $ per 100g
Kilde: Lanthanum ble ikke funnet gratis i naturen. Den finnes hovedsakelig i mineralene monazitt og bastnaesitt. Kommersielt blir det utvunnet fra monazitt sand og bastnaesitt ved hjelp av forskjellige komplekse ekstraksjonsteknikker. Rent lantan oppnås ved reduksjon av fluor med kalsiummetall.
Isotoper: Lanthanum har 31 isotoper hvis halveringstid er kjent, med massetall 119 til 150. Av disse er en stabil, 139La. Naturlig forekommende lantan er en blanding av de to isotopene 138La og 139La med naturlige overflod på henholdsvis 0,09% og 99,91%.

Sitere denne siden
For å koble til på nettet, vennligst kopier og lim inn ett av følgende:
<a href="https://www.chemicool.com/elements/lanthanum.html">Lanthanum</a>
eller
<a href="https://www.chemicool.com/elements/lanthanum.html">Lanthanum Element Facts</a>
For å sitere denne siden i et akademisk dokument, bruk følgende MLA-kompatible sitat:
"Lanthanum." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/lanthanum.html>.