Informasjonsbehandling er viktig innen alle fagfelt. I molekylærbiologi er den sentrale dogmen, først laget av Francis Crick (Crick, 1958, 1970), en klassisk ryggrad i levende celler for å fundamentalt utføre prosesser fra celledeling til død gjennom DNA-, RNA- og proteininformasjonsveiene. Mer spesifikt beskriver det sentrale dogmet overføringen av sekvensinformasjon under DNA-replikasjon, transkripsjon til RNA og translasjon til aminosyrekjeder som danner proteiner. Samtidig står det også at informasjon ikke kan strømme fra protein til protein eller nukleinsyre.
Siden ankomsten av systemiske og høye gjennomstrømningsmetoder de siste to tiårene, er disse brede trinnene, som ikke inkluderer kompliserte forskriftsmessige detaljer, har blitt undersøkt intenst. De manglende regulatoriske funksjonene, slik som DNA-korrektur / reparasjonsmekanismer og alternativ spleising av pre-mRNA, introduserer flere mellomliggende trinn. Disse ekstra trinnene forstyrrer de viktigste trinnene i dogmen og vil sannsynligvis endre informasjonsdynamikken. I tillegg ser det ut til at epigenetikk, eller rollen som kromatinstrukturer, DNA-metylering og histonmodifikasjoner spiller, strider mot dogmens enkle veier (Shapiro, 2009; Luco et al., 2011). Proteinsplitting, eller evnen til et protein (inteiner) til å endre sin egen sekvens, oppdaget i nyere tid (Volkmann og Mootz, 2012) og prioner, som modifiserer andre proteinsekvenser (Prusiner, 1998), omgår informasjonsoverføringsveien til dogme. Andre undersøkelser rapporterte om feil eller uoverensstemmelser mellom RNA-sekvenser og deres kodende DNA (Hayden, 2011; Li et al., 2011). Samlet sett tviler disse dataene på gyldigheten til det sentrale dogmet i sammenheng med dagens vitenskap, og setter derfor spørsmålstegn ved enkelheten av lineær informasjonsflyt (DNA til RNA og RNA til protein).
For å sette ting i perspektiv, krever vi analytiske verktøy som undersøker bekymringene eller avvikene med hensyn til den mangeårige teorien. En enkel, men likevel svært nyttig teknikk for å søke på globale egenskaper i datasett med høy gjennomstrømning, er statistisk korrelasjonsanalyse, som har blitt brukt mye og vellykket for å observere mønstre i komplekse systemer som været (Stewart, 1990), aksjemarkeder (Lo og MacKinlay , 1988) og kosmologi (Amati et al., 2008). Det er flere typer korrelasjonsanalyser som evaluerer både lineære (f.eks. Pearson produktmoment) og ikke-lineære (f.eks. Spearmans rang, gjensidig informasjon) avhengigheter (Steuer et al., 2002; Rosner, 2011). , har Pearson produkt-øyeblikk korrelasjonsanalyse blitt den mest populære på grunn av dens evne til å vise organisasjonsstruktur i den enkleste formen.
I biologi har det vært mange arbeider som har studert korrelasjonene i mRNA og data om proteinuttrykk (se nedenfor og tabell 1). I teorien, når to prøver som inneholder høydimensjonale (som mikroarray og proteomiske) data, sammenlignes, gir korrelasjonsanalysene et mål på avvik fra enhet som en kilde til forskjell mellom prøvene Kort sagt vil to prøver med identisk og fullstendig ikke-identisk informasjon vise henholdsvis enhet (R2 = 1) og null (R2 = 0) korrelasjon.
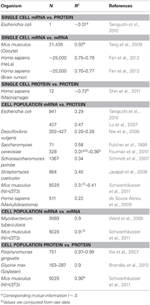
Tabell 1. mRNA og protein uttrykk essionskorrelasjoner i forskjellige organismer.
Perfekt korrelasjon (R2 = 1) er en idealisert situasjon som er langt fra virkeligheten, som teknisk eller eksperimentell støy alene forstyrrer og reduserer korrelasjonen. Videre har de siste årene fremhevet eksistensen av biologisk støy: studiene på individuelle celler og molekyler har vist stokastisitet i genuttrykksdynamikk på grunn av den kombinatoriske effekten av lave molekylære kopitall og den karakteristiske naturen til promotordynamikk (Raj og van Oudenaarden, 2009; Eldar og Elowitz, 2010). På den annen side viser klonale populasjoner av celler heterogenitet i nivåene av et gitt proteinuttrykk per celle til enhver tid (Chang et al., 2008). Tilsammen er stokastisitet og heterogenitet avgjørende for å produsere diversifisering av celleskjebner, fenotypiske variasjoner og forsterkning av intracellulære signaler (Locke et al., 2011; Selvarajoo, 2012).
De stokastiske svingningene, eller den iboende støyen, forårsaker uttrykket av en molekylart å variere i tid og mellom celler, noe som fører til ukorrelerte responser (Elowitz et al., 2002). Dette er spesielt fremtredende for mRNA og proteiner med lave kopitall. Dermed kan korrelasjonen mellom prøvene (celler) senkes på grunn av egenstøy (figur 1A). Andre kilder til biologisk støy på grunn av ytre faktorer inkluderer variasjon i cellestørrelse, molekylære kopitall og miljøsvingninger mellom individuelle celler.Disse faktorene forvrenger det deterministiske sentrale dogmet og endrer sannsynligvis sterke sammenhenger til svakere (figur 1B).
En nylig studie sammenlignet Escherichia coli mRNA og proteinuttrykk mellom individuelle celler på enkeltmolekylnivå og ga et scenario som setter spørsmålstegn ved det sentrale dogmet. Taniguchi et al. (2010) avslørte at det ikke er noen korrelasjon (R2 ~ 0) mellom individuell tufA mRNA og proteinnivå i enkeltceller. Spesielt konkluderte de med at mangelen på korrelasjon sannsynligvis skyldes forskjeller i mRNA og protein levetid. Selv om dette er en sannsynlig forklaring, har Taniguchi et al. var forsiktige med å ikke motbevise den langvarige hypotesen ved å hevde at tidsgjennomsnitt for mRNA-nivåer skulle korrelere med proteinnivå. Det var imidlertid ingen bevis som viste at dette er det faktiske tilfellet, og da vi vurderte ikke-lineære avhengigheter ved hjelp av gjensidig informasjon (Steuer et al., 2002; Tsuchiya et al., 2010) i Taniguchi et al. datasett, fant vi resultatet ikke-avhengig, dvs. jeg ~ 0. Dette bekrefter at mRNA til proteinuttrykk mellom individuelle celler på enkelt molekylnivå er tydeligvis ikke relatert. Videre, når du zoomer på enkeltmolekylnivå i korrelasjonsplottet, er det tydelig at deres parvise korrelasjoner er svake (figur 1A, sett inn, for illustrasjon).
Spesielt på cellepopulasjonsnivå, Taniguchi et al. var i stand til å vise relativt høy korrelasjon mellom mRNA og proteinuttrykk med R2 = 0,29 (figur 2A). Faktisk en annen uavhengig studie av Lu et al. (2007), for E. coli-populasjonen, viste også relativt høy korrelasjon (R2 = 0,47). Lignende analyser utført på Saccharomyces cerevisiae (Futcher et al., 1999), murin NIH / 3T3 fibroblast (Schwanhäusser et al., 2011) og flere andre cellepopulasjoner (Nie et al., 2006; Schmidt et al., 2007; Jayapal et. al., 2008; de Sousa Abreu et al., 2009) viste alle korrelerte strukturer mellom transkriptomdekkende og proteomdekkende uttrykk (tabell 1). Så hvorfor er det ingen sammenheng mellom individuelt mRNA og proteinuttrykk i enkeltceller, mens det på populasjonsnivå observeres kollektive forhold mellom storskala mRNA og proteinuttrykk?
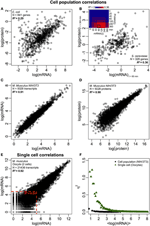
Figur 2. Uttrykk-korrelasjoner rundt hele bredden. Cellepopulasjoner: mRNA-proteinkorrelasjoner i (A) E. coli (Taniguchi et al., 2010) og (B) S. cerevisiae (Fournier et al., 2010) mellom mRNA-uttrykk ved t = 60 min og proteinuttrykk ved t = 360 min. Sett inn: korrelasjonsmatrise mellom alle tidspunkter viser en forsinket økning i korrelasjoner mellom mRNA og proteiner. (C) mRNA og (D) proteinuttrykk mellom to prøver av murine NIH / 3T3-celler (Schwanhäusser et al., 2011). Enkeltceller: (E) mRNA-uttrykk mellom to oocytter (Tang et al., 2009). De røde prikkede linjene indikerer regionene med lave mRNA-uttrykk (log (mRNA) < 5). (F) Støy (η2) versus log (mRNA-uttrykk) for cellepopulasjon (NIH / 3T3, svarte prikker, Schwanhäusser et al., 2011) og enkeltceller (Oocytter, grønne trekanter, Tang et al., 2009). Hver prikk representerer verdien for en gruppe P = 100 mRNA. η2 er nær null for cellepopulasjonen for alle mRNA-uttrykk. For enkeltceller er η2 høyest for mRNAer med lavest kopitall, og nærmer seg null for høyere kopitall.
Vi tror det er to hovedårsaker til forskjellene. For det første, som nevnt tidligere, reduserer støy, enten det er biologisk eller ikke-biologisk, korrelasjonen. Siden analyser på enkeltceller har vist viktigheten av stokastisitet og variabilitet, er disse effektene avgjørende for å redusere enkeltcellekorrelasjoner. På ensemblenivå, når celler samples i en populasjon, reduseres den totale (iboende + ekstrinsiske) støyen, ettersom tilfeldig støy kanselleres over alle molekylære uttrykk (figur 1C – F), for å avsløre gjennomsnittlig respons og egenorganisering ( Karsenti, 2008; Selvarajoo, 2011; Hekstra og Leibler, 2012; Selvarajoo og Giuliani, 2012). Derfor dukker det opp en god grad av mRNA-protein-ekspresjonskorrelasjon. For det andre, for enkeltcellestudien (Taniguchi et al., 2010) ble individuell mRNA-proteinekspresjonskorrelasjon sammenlignet på tvers av mange celler. I cellepopulasjonsstudier blir sammenligningen imidlertid gjort i sin helhet, over tusenvis av mRNA og proteiner over flere størrelsesordener større enn uttrykksområdet som ble funnet for enkeltmolekyl mellom celler. Dette fører derfor til høyere korrelasjoner på populasjonsnivå ettersom effekten av enkeltmolekylære variasjoner blir ubetydelig.
Til tross for at korrelerte strukturer blir observert for cellepopulasjoner, er det konkrete årsaker til det store avviket fra perfekt korrelasjon.Som nevnt tidligere, er et sentralt poeng at mRNA og proteiner er sekvensielt lokalisert med flere manglende prosesser, ikke representert i det sentrale dogmet. Å legge til de manglende mellomproduktene langs en biokjemisk vei vil medføre en merkbar forsinkelse i informasjonsflyten (Selvarajoo, 2006, 2011; Piras et al., 2011), og korrelasjonen mellom dem kan lide som et resultat. Dette kan også være en del av det faktum som Taniguchi et al. at mRNA og proteinuttrykk har forskjellige levetider. Spesielt er denne postuleringen støttet i et nylig arbeid med S. cerevisiae behandlet med Rapamycin som viste at de temporale korrelasjonene av mRNA-proteinuttrykk var opprinnelig lave, R2 = 0,01 ved 40 minutter, likevel, over 360 minutter etter forstyrrelse, økte korrelasjonen, R2 = 0,36 (Fournier et al., 2010, figur 2B). Dataene indikerer at ved kjemisk forstyrrelse avviker den innledende responsen mellom mRNA og proteinuttrykk på grunn av tidsforsinkelse og forskjellige kinetiske mekanismer mellom dem, samt sekundære effekter som autokrin eller parakrin signalinterferens (Shvartsman et al., 2002; Isalan et al., 2008). Når effekten av forstyrrelsen dempes over tid, skjedde utvinningen av korrelasjoner.
For ytterligere å kontrollere postuleringen om at sekvensielle forsinkelsesprosesser eller forskjellige levetider er avgjørende for å redusere mRNA-proteinkorrelasjoner, sammenlignet vi R2 mellom samme molekylære arter av det sentrale dogmet (f.eks. mellom mRNA og mRNA) i cellepopulasjoner og enkeltceller. Den transkriptomdekkende mRNA-mRNA-ekspresjonskorrelasjonen mellom replikater av NIH / 3T3 (Schwanhäusser et al., 2011) (figur 2C) og Mycobacterium tuberculosis (Ward et al., 2008) cellepopulasjonsprøver er begge veldig høye, med R2 > 0.9 (tabell 1). Slike sterke sammenhenger observeres også mellom populasjonsprøver for protein-proteinuttrykk i NIH / 3T3-celler (Schwanhäusser et al., 2011) (figur 2D), Porphyromonas gingivalis (Xia et al., 2007) og Glycine max (Brandão et al. , 2010) (Tabell 1). Siden disse dataene som sammenligner samme art gir svært høye korrelasjoner, kan det tenkes at de sekvensielle forsinkelsesprosessene eller forskjellige levetider er ansvarlige for å senke populasjonsnivå korrelasjonsstrukturer mellom mRNA og proteinuttrykk.
I enkelt murine oocytter ( Tang et al., 2009), når man sammenligner hele mRNA – mRNA-uttrykk, observeres en sterkt korrelert struktur (R2 = 0,92, figur 2E). Imidlertid, bare med fokus på lavt uttrykte mRNAer (med logaritmiske uttrykk < 5), senker den stokastiske støyen den parvise korrelasjonen ganske dramatisk (R2 < 0,54). For å undersøke dette resultatet vurderte vi støy, η2 = σ2XY / μ2XY, over hele mRNA-uttrykk (figur 2F). Vi bemerket at η2 er høyest for de laveste uttrykkene, på grunn av den uttalt effekten av stokastiske svingninger i forhold til deres uttrykk, og nærmer seg null for høyere uttrykk, der slik støy blir mindre signifikant (Piras et al., 2012). For cellepopulasjon, som forventet, observeres det nesten null støy over hele uttrykksområdet på grunn av kansellering av tilfeldig støy (figur 1E, F).
Svært korrelerte strukturer for hele mRNA – mRNA-uttrykk var også rapportert for enkelt kreftcelle (Fan et al., 2012), om enn mindre signifikant med R2 ~ 0,7 (tabell 1). Videre viste sammenligning av protein-proteinuttrykk i LPS-stimulerte humane makrofager også høye korrelasjoner, R2 ~ 0,72 (Shin et al., 2011) (tabell 1). Selv om det ikke er noen sammenheng mellom individuelle mRNA-proteinuttrykk i enkeltceller, er den store eller omiske hele korrelasjonen mellom samme molekylære arter i enkeltceller veldig høy.
Således, enten enkeltceller eller cellepopulasjoner , indikerer de omics-brede dataene at korrelasjonene mellom de samme molekylære artene (mRNA vs. mRNA, og protein vs. protein) er merkbart høyere enn mellom forskjellige arter (mRNA vs. protein). Dette gjenspeiler det faktum at selv om tidsforsinkelsesprosesser og forskjellige levetider er nøkkelen til å redusere korrelasjoner, er disse mekanismene ikke tilstrekkelige for å støtte mangelen på korrelasjonsstruktur observert mellom enkeltcellers individuelle transkripsjon til proteinuttrykk.
Så langt, gjennom å undersøke store uttrykk for mRNA og proteiner fra forskjellige cellulære systemer, har vi vist at korrelasjonsstrukturer dukker opp i global skala. Imidlertid avslører korrelasjonsanalysene bare forbindelsen mellom to testede prøver, og viser ikke retningen til For at sentralt dogme skal være gyldig på en global skala, bør den samlede informasjonsflyten være fra DNA til proteiner. Slik informasjonsflyt har blitt demonstrert av utallige andre studier som involverer forstyrrelse av reseptorene til cellepopulasjoner og overvåking av den resulterende dynamikk av transkripsjonsfaktorer som binder seg til DNA og induksjon av storskala genuttrykk (figur 3A).For eksempel, i tilfelle av LPS-stimulerte immunceller, er det blitt demonstrert at aktiveringen av transkripsjonsfaktoren NF-KB skjer rundt 15 minutter (Liu et al., 1999), induksjon av dens nedstrømsgener ved ca. min (Liu et al., 1999; Xaus et al., 2000; Selvarajoo et al., 2008), og oversettelsen av de tilsvarende proteiner i området 60-90 min (Kawai et al., 1999; Xaus et al. ., 2000) (figur 3B). Slike sekvensiell retning av den totale transkripsjonen til oversettelsesinformasjonsflyt observeres også for bakteriesystemer, slik som E. coli, på cellepopulasjonsnivå (Golding et al., 2005).

Figur 3. Informasjonsflyten til sentral dogme. (A) Skjematisk LPS / TLR4-indusert TNF-ekspresjon, via transkripsjonsfaktor NF-KB og tnf-genet, etter lineær informasjonsflyt. (B) eksperimentelle tidsmessige profiler av promotor bindende aktivitet av NF-KB (øvre paneler), tnf (midtpaneler) og TNF (nedre paneler) uttrykk på cellepopulasjonsnivå. (C) Skjematiske tidsmessige profiler av promotordynamikk, mRNA og proteinuttrykk på enkeltcellenivå (Raj og van Oudenaarden, 2009).
Alternativt avslører undersøkelser ved enkeltcelleoppløsning tilfeldige svingninger over den lineære informasjonsflyten: transkripsjonsfaktorene som er bindende til DNA-promoterregioner er quantal, noe som resulterer i sprekkende oppførsel av mRNA-transkripsjonen og induserer deretter variasjon i proteinoversettelsen, til og med mellom identiske celler (figur 3C) (Raj og van Oudenaarden, 2009; Eldar og Elowitz, 2010; Locke et al., 2011; Hekstra og Leibler, 2012; Selvarajoo, 2012). Som et resultat, på et hvilket som helst bestemt tidspunkt, er den individuelle molekylære responsen for enkeltceller ganske støyende sammenlignet med populasjonsgjennomsnittet (Selvarajoo, 2011).
Konklusjoner
Eksemplene vist i denne artikkelen fremhever forskjellene i rekkefølgen av korrelasjonsverdier observert mellom arter i den sentrale dogmen over cellepopulasjoner og enkeltceller. De statistiske analysene fra cellepopulasjoner tegner et bilde av at uttrykkets korrelasjon mellom samme molekylart er veldig høy og mellom arter er moderat høy. Selv om encellekorrelasjoner mellom den samme arten er sammenlignbare med cellepopulasjoner, viste de en større spredning i deres uttrykkstegninger på grunn av den uttalt effekten av biologisk støy, spesielt for transkripsjoner med lave kopitall. Spesielt blir enkeltcellene «parvis korrelasjon null for individuelle molekyler (Taniguchi et al., 2010). Faktisk er det kjent at stokastiske svingninger og variasjon i molekylære uttrykk er funksjonelle for å generere beslutning om celleskjebne og tippe cellulære tilstander (Losick og Desplan, 2008; Eldar og Elowitz, 2010; Kuwahara og Schwartz, 2012. , 2008) som resulterer i fremvoksende gjennomsnittsresponser.Analyser av lite antall eller individuelle molekyler, kan ikke korrelasjonsstrukturen observeres.
Samlet sett kan det tenkes at visning av informasjonsflyten av enkelt DNA til protein vil stille spørsmål ved det sentrale dogmet ettersom responsen til hvert molekyl til enhver tid ikke sannsynligvis vil korrelere. Imidlertid antyder observasjonen av gjennomsnittlig deterministisk respons at netto likevekten til genet ic informasjon forblir helt til høyre for stiene. Derfor bør den sentrale dogmen ses på som en makroskopisk cellulær informasjonsflyt i en omics-bred skala, og ikke på et enkelt gen til proteinnivå. Som sådan tror vi at dens enkelhet vil fortsette å forbli en av de mest innflytelsesrike teoretiske søylene i levende systemer.
Erklæring om interessekonflikter
Forfatterne erklærer at forskningen ble utført i fraværet av kommersielle eller økonomiske forhold som kan tolkes som en potensiell interessekonflikt.
Anerkjennelser
Kentaro Hayashi takkes for kommentarer. Forskningsfondet i Tsuruoka city og Yamagata Prefecture er verdsatt for deres støtte.
Crick, F. (1958). På proteinsyntese. Symp. Soc. Utløpsdato Biol. 12, 139–163.
Pubmed Abstract | Pubmed fulltekst
Crick, F. (1970). Sentral dogme av molekylærbiologi. Nature 227, 561-563.
Pubmed Abstract | Pubmed fulltekst
Hayden, E. C. (2011). Bevis på endret RNA vekker debatt. Nature 473, 432.
Pubmed Abstract | Pubmed fulltekst | CrossRef Full Text
Hekstra, D. R. og Leibler, S. (2012). Beredskap og statistiske lover i replikere mikrobielle lukkede økosystemer. Cell 149, 1164–1173.
Pubmed Abstract | Pubmed fulltekst | CrossRef Full Text
Kuwahara, H., and Schwartz, R. (2012).Stokastisk steady state gevinst i en genuttrykkingsprosess med mRNA nedbrytningskontroll. J. R. Soc. Grensesnitt 9, 1589–1598.
Pubmed Abstract | Pubmed fulltekst | CrossRef Full Text
Nie, L., Wu, G. og Zhang, W. (2006). Korrelasjon av mRNA-uttrykk og protein overflod påvirket av flere sekvensfunksjoner relatert til translasjonseffektivitet i Desulfovibrio vulgaris: en kvantitativ analyse. Genetikk 174, 2229-2243.
Pubmed Abstract | Pubmed fulltekst | CrossRef Full Text
Prusiner, S. B. (1998). Prions. Proc. Natl. Acad. Sci. U.S.A. 95, 13363–13383.
Pubmed Abstract | Pubmed fulltekst | CrossRef Full Text
Rosner, B. (2011). Grunnleggende om biostatistikk. 7. utg. Boston, MA: Duxbury Press.
Selvarajoo, K. (2006). Oppdager differensialaktiveringsmaskineri for de tolllignende reseptor 4 signalveiene i MyD88 knockouts. FEBS Lett. 580, 1457–1464.
Pubmed Abstract | Pubmed fulltekst | CrossRef Full Text
Selvarajoo, K. (2011). Makroskopisk lov om bevaring avslørt i populasjonsdynamikken til toll-lignende reseptorsignalering. Cell Commun. Signal. 9, 9.
Pubmed Abstract | Pubmed fulltekst | CrossRef Full Text
Selvarajoo, K. (2012). Forstå multimodale biologiske beslutninger fra enkeltcelle og populasjonsdynamikk. Wiley Interdiscip. Pastor Syst. Biol. Med. 4, 385–399.
Pubmed Abstract | Pubmed fulltekst | CrossRef Full Text
Stewart, T. R. (1990). En spaltning av korrelasjonskoeffisienten og dens bruk for å analysere prognoseferdigheter. Værmelding. 5, 661–666.