Forholdet mellom trykk og volum: Boyles lov
Når trykket på en gass øker, reduseres gassvolumet fordi gasspartiklene tvinges nærmere hverandre. Omvendt, når trykket på en gass synker, øker gassvolumet fordi gasspartikler kan nå bevege seg lenger fra hverandre. Værballonger blir større når de stiger gjennom atmosfæren til områder med lavere trykk fordi gassvolumet har økt; det vil si at den atmosfæriske gassen utøver mindre trykk på overflaten av ballongen, så indre gass utvides til det indre og eksterne trykket er likt.
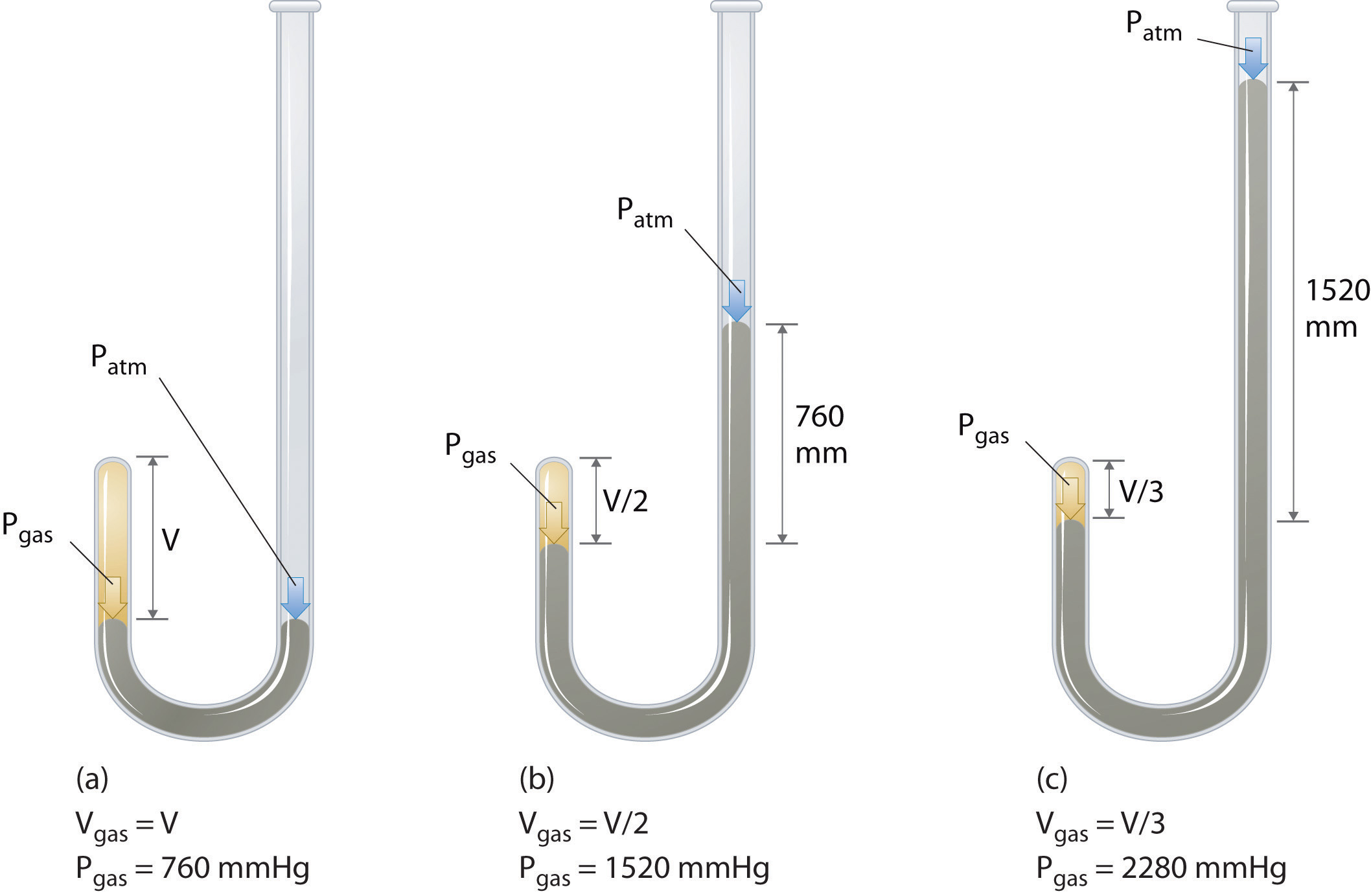
Den irske kjemikeren Robert Boyle (1627–1691) utførte noen av de tidligste eksperimentene som bestemte det kvantitative forholdet mellom trykket og volumet av en gass. Boyle brukte et J-formet rør delvis fylt med kvikksølv, som vist i figur \ (\ PageIndex {1} \). I disse eksperimentene fanges en liten mengde gass eller luft over kvikksølvkolonnen, og volumet blir målt ved atmosfæretrykk og konstant temperatur. Mer kvikksølv helles deretter i den åpne armen for å øke trykket på gassprøven. Trykket på gassen er atmosfæretrykk pluss forskjellen i høyden på kvikksølvkolonnene, og det resulterende volumet måles. Denne prosessen gjentas til det enten ikke er mer plass i den åpne armen eller at gassvolumet er for lite til å kunne måles nøyaktig. Data som de fra et av Boyles egne eksperimenter kan plottes på flere måter (Figur \ (\ PageIndex {2} \)). Et enkelt plott av \ (V \) versus \ (P \) gir en kurve som kalles hyperbola og avslører et omvendt forhold mellom trykk og volum: når trykket dobles, reduseres volumet med en faktor på to. Dette forholdet mellom de to størrelsene er beskrevet som følger:
\
Å dele begge sider med \ (P \) gir en ligning som illustrerer det omvendte forholdet mellom \ (P \) og \ (V \):
\
eller
\
der the-symbolet leses «er proporsjonalt med.» Et plott av V versus 1 / P er altså en rett linje hvis stigning er lik konstanten i ligningene \ (\ ref {10.3.1} \) og \ (\ ref {10.3.3} \). Deling av begge sider av Ligning \ (\ ref {10.3.1} \) av V i stedet for P gir et lignende forhold mellom P og 1 / V. Den numeriske verdien av konstanten avhenger av mengden gass som brukes i eksperimentet og av temperaturen ved hvilken eksperimentene blir utført. Dette forholdet mellom trykk og volum er kjent som Boyles lov, etter oppdageren, og kan sies som følger: Ved konstant temperatur er volumet av en fast mengde gass omvendt proporsjonalt med trykket. lov i praksis er vist i figur \ (\ PageIndex {2} \).
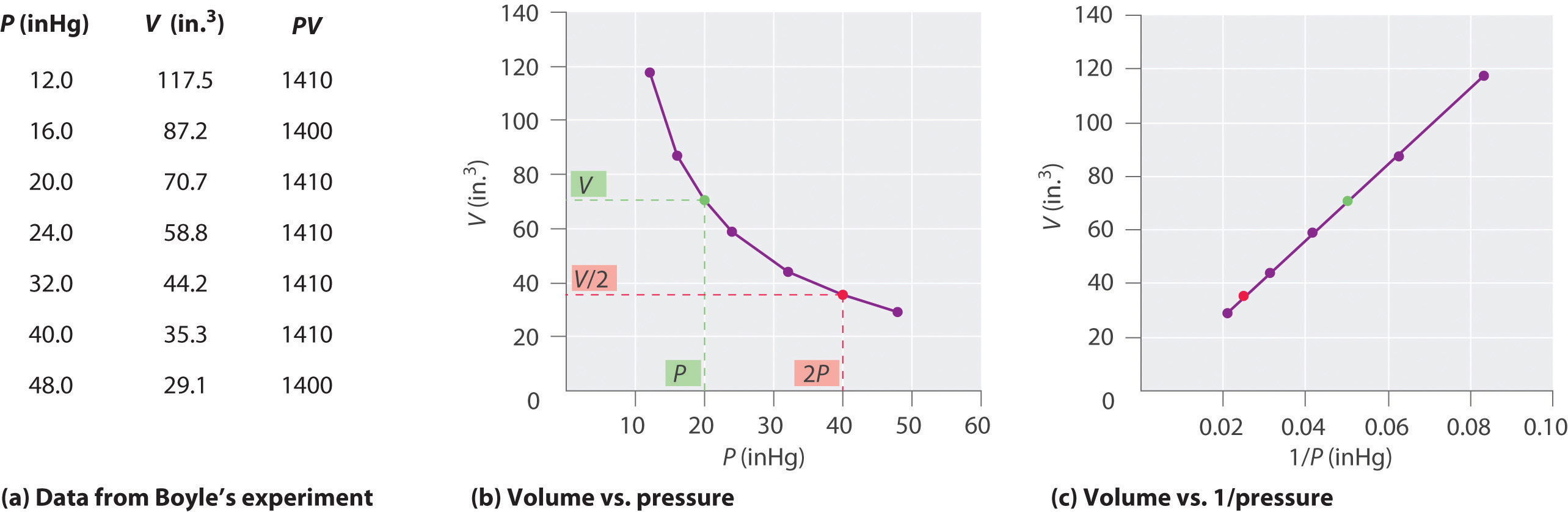
Ved konstant temperatur er volumet av en fast mengde av en gass omvendt proporsjonal med trykket