산과 염기의 정의
물의 역할
보일에 따른 산과 염기의 특성
1661 년 Robert Boyle은 산의 특성을 다음과 같이 요약했습니다.
1. 산은 신맛이 있습니다.
2. 산은 부식성이 있습니다.
3. 산은 aslitmus와 같은 특정 식물성 염료의 색상을 파란색에서 빨간색으로 변경합니다.
4. 산은 알칼리와 결합 할 때 산도를 잃습니다.
“산”이라는 이름은 “신맛”을 의미하는 라틴어 acidus에서 유래되었으며 많은 산의 날카로운 냄새와 신맛을 나타냅니다.
예 : 식초는 물에 아세트산을 희석 한 용액이기 때문에 신맛이납니다. 레몬 주스에는 구연산이 함유되어있어 신맛이납니다. 젖산이 형성되어 우유가 상하면 신맛이 나고, 썩은 고기 나 버터의 불쾌하고 신맛이 나는 냄새는 지방이 상할 때 형성되는 부티르산과 같은 화합물 때문일 수 있습니다.
1661 년 보일은 알칼리의 특성을 요약했습니다. 다음과 같습니다.
- 알칼리가 미끄 럽게 느껴집니다.
- 알칼리가 리트머스의 색을 빨간색에서 파란색으로 바꿉니다.
- 알칼리와 결합하면 알칼리성이 약해집니다. 본질적으로 Boyle은 알칼리를 산을 소비하거나 중화시키는 물질로 정의했습니다. 산은 알칼리와 혼합되면 특유의 신맛과 금속 용해 능력을 잃고, 심지어 리트머스 콤이 산과 접촉 할 때 발생하는 색 변화를 역전시킵니다. 결국 알칼리는 특정 염을 만들기위한 “염기”역할을하므로 염기로 알려지게되었습니다.

산과 염기의 Arrhenius 정의
1884 년 Svante Arrhenius는 NaCl과 같은 염이 물에 용해 될 때 해리되어 이온이라고하는 입자를 생성한다고 제안했습니다.
H2O NaCl (s) 
Na + (aq) + Cl- (aq) 3 년 후 Arrhenius는 산이 물에 용해 될 때 이온화되어 H + 이온과 이에 상응하는 음이온을 생성하는 중성 화합물임을 제안함으로써이 이론을 확장했습니다. 그의 이론에 따르면 염화수소는 물에 용해되면 이온화되어 아래 그림과 같이 수소 (H +)와 염화물 (Cl-) 이온을 생성하기 때문에 산성입니다.
H2O HCl (g) 
H + (aq) + Cl- (aq) 
Arrhenius는 염기가 물에서 해리되거나 이온화되어 OH- 이온과 양성 이온을 생성하는 중성 화합물이라고 주장했습니다. NaOH는 수 중에서 해리되어 수산화물 (OH-) 및 나트륨 (Na +) 이온을 생성하기 때문에 Arrhenius 염기입니다.
H2O NaOH (s) 
Na + (aq) + OH- (aq) 따라서 Arrhenius 산은 물에 용해되어 H + 또는 수소 이온을 생성 할 때 이온화되는 모든 물질입니다.
Arrhenius 염기는 물에 용해 될 때 OH- 또는 수산화물 이온을 제공하는 물질입니다. 아 레니 우스 산에는 물에서 이온화되어 H + 이온을 생성하는 HCl, HCN 및 H2SO4와 같은 화합물이 포함됩니다. 아 레니 우스 염기에는 NaOH, KOH 및 Ca (OH) 2와 같은 OH- 이온을 포함하는 이온 화합물이 포함됩니다.
이 이론은 산이 유사한 특성을 갖는 이유를 설명합니다. 산의 특성은 H +의 존재로 인해 발생합니다. 산이 물에 녹을 때 생성되는 이온 산이 염기를 중화시키는 이유와 그 반대의 이유도 설명합니다. 산은 H + 이온을 제공합니다. 염기는 OH- 이온을 제공합니다. 이 이온들이 결합하여 물을 형성합니다.
H + (aq) + OH- (aq)
 H2O (l)
H2O (l) Arrhenius 이론에는 몇 가지 단점이 있습니다. .
- 화합물이 물에 녹을 때 일어나는 일의 관점에서 산과 염기를 정의하기 때문에 물에서 일어나는 반응에만 적용 할 수 있습니다.
- 그렇지 않습니다. 수소의 산화수가 +1 인 일부 화합물 (예 : HCl)이 물에 용해되어 산성 용액을 생성하는 반면 다른 화합물 (예 : CH4)은 그렇지 않은 이유를 설명합니다.
- OH- 이온을 포함하는 화합물 만 Arrhenius 염기로 분류 할 수 있습니다. Arrhenius 이론은 다른 화합물 (예 : Na2CO3)이 염기의 특징적인 특성을 갖는 이유를 설명 할 수 없습니다.

수용액의 화학에서 H + 및 OH- 이온의 역할
수소 (EN = 3.44)가 수소 (EN = 2.20)보다 훨씬 더 전기 음성 적이기 때문에 물 속의 HO 결합에있는 전자는 “수소와 산소 원자가 동등하게 공유하지 않습니다. 이 전자들은 분자 중심의 산소 원자쪽으로 끌려 가고 양쪽 끝의 수소 원자에서 멀어집니다. 결과적으로 물 분자는 극성입니다. 산소 원자는 부분 음전하 (-)를 전달하고 수소 원자는 부분 양전하 (+)를 전달합니다.

이온을 형성하면 물 분자는 양으로 하전 된 H + 이온과 음으로 하전 된 OH- 이온을 형성합니다.

반대 반응이 발생할 수도 있습니다. H + 이온은 OH- 이온과 결합하여 중성 물 분자를 형성 할 수 있습니다.

물 분자가 해리되어 H + 및 OH- 이온을 형성하고 다시 결합하여 물 분자를 형성한다는 사실은 다음 방정식으로 표시됩니다.


물은 이온을 형성하기 위해 어느 정도까지 분리됩니까?
25C에서 물의 밀도는 0.9971g / cm3 또는 0.9971g / mL입니다. 따라서 물의 농도는 55.35 몰입니다.

이 온도에서 중성 H2O 분자의 해리에 의해 형성된 H + 및 OH- 이온의 농도는 다음과 같습니다. 1.0 x 10-7 mol / L에 불과합니다. H + (또는 OH-) 이온 농도와 중성 H2O 분자 농도의 비율은 따라서 1.8 x 10-9입니다.

즉, 물 분자의 약 2ppb (ppb)만이 실온에서 이온으로 분리됩니다. 아래 그림은 20 개의 물 분자 모델을 보여 주며, 그중 하나는 해리되어 한 쌍의 H + 및 OH- 이온을 형성합니다. 이 그림이 물의 구조에 대한 고해상도 사진이라면, 우리는 그러한 사진이 2,500 만 장에 대해 평균 한 번에 불과한 한 쌍의 H + 및 OH- 이온을 만날 것입니다.


산의 작동 정의 및 염기
물이 해리되어 가역 반응에서 H + 및 OH- 이온을 형성한다는 사실은 Arrhenius가 제안한 정의보다 더 강력한 산과 염기의 작동 정의를위한 기초입니다. 운영상의 의미에서 산은 물에 용해 될 때 H + 이온의 농도를 증가시키는 모든 물질입니다. 염기는 물에 용해 될 때 OH- 이온의 농도를 증가시키는 물질입니다.
이러한 정의는 산과 염기에 대한 실험실 테스트를 단순화하기 위해 산과 염기의 이론을 연결합니다. 화합물이 산인지 염기인지 결정하기 위해 우리는 그것을 물에 녹이고 용액을 테스트하여 H + 또는 OH- 이온 농도가 증가했는지 확인합니다.

일반적인 산과 염기
산과 염기의 특성은 금속과 수산화물, 산화물 및 수산화물과 같은 화합물의 화학에서 볼 수 있듯이 비금속.
비금속에 결합 된 수소를 포함하는 화합물을 비금속 수 소화물이라고합니다. +1 산화 상태의 수소를 포함하고 있기 때문에 이러한 화합물은 물에서 H + 이온의 공급원 역할을 할 수 있습니다.

반면에 금속 수 소화물은 금속에 결합 된 수소를 포함합니다. 이러한 화합물은 a-1 산화 상태의 수소를 포함하고 있기 때문에 물에서 해리되어 H- (또는 수 소화물) 이온을 생성합니다.

가전 자 쌍과 함께 H- 이온은 물 분자에서 H + 이온을 추출 할 수 있습니다.

물 분자에서 H + 이온을 제거하는 것이 용액의 OH- 이온 농도를 증가시키는 일방 통행이므로 금속 수 소화물은 염기입니다.

금속과 비금속에 의해 형성된 산화물의 화학에서도 유사한 패턴을 찾을 수 있습니다. 비금속 산화물은 물에 용해되어 산을 형성합니다. CO2는 물에 용해되어 탄산을 생성하고 SO3는 황산을 생성하며 P4O10은 물과 반응하여 인산을 생성합니다.

금속 산화물 반면에는 염기입니다. 금속 산화물은 공식적으로 O2- 이온을 포함하며, 물과 반응하여 한 쌍의 OH- 이온을 생성합니다.

따라서 금속 산화물은 다음의 운영 정의에 적합합니다. abase.

 OH를 포함하는 화합물의 화학에서 동일한 패턴을 봅니다. 또는 수산화물, 그룹. LiOH, NaOH, KOH 및 Ca (OH) 2와 같은 금속 수산화물은 염기입니다.
OH를 포함하는 화합물의 화학에서 동일한 패턴을 봅니다. 또는 수산화물, 그룹. LiOH, NaOH, KOH 및 Ca (OH) 2와 같은 금속 수산화물은 염기입니다. 
비금속 수산화물, 하이포 아 염소산 (HOCl)과 같은 것은 산입니다.

아래 표는 이러한 세 가지 화합물 범주에서 관찰 된 경향을 요약 한 것입니다. 금속 수 소화물, 금속 산화물 및 금속 수산화물은 염기입니다. 비금속 수 소화물, 비금속 산화물 및 비금속 수산화물은 산입니다.
전형적인 산 및 염기
위 표에서 비금속 수산화물의 산성 수소 원자는 질소에 결합되지 않습니다. 황, 또는 인 원자. 각 화합물에서 산성 수소는 산소 원자에 부착됩니다. 따라서 이러한 화합물은 모두 옥시 산의 예입니다.
8 개의 옥시 산에 대한 골격 구조가 아래 그림에 나와 있습니다. 일반적으로 , 산소를 포함하는 산은 산성 수소가 산소 원자에 부착 된 골격 구조를 가지고 있습니다.








연습 문제 1 :Lewis 구조를 사용하여 다음 산을 비금속 수 소화물 (XH) 또는 비금속 수산화물 (XOH)로 분류합니다.
(a) HCN
(b) HNO3
(c) H2C2O4
(d) CH3CO2H
실습 문제 1에 대한 답을 확인하려면 여기를 클릭하십시오.

왜 금속 수산화물 염기와 비금속 수산화물 산이 있습니까? 비금속 수산화물이 산이고 금속 수산화물이 염기 인 이유를 이해하려면 이러한 화합물에서 원자의 전기 음성도를 살펴 봐야합니다. 일반적인 금속 수산화물 인 수산화 나트륨으로 시작하겠습니다.

나트륨과 산소의 전기 음성도의 차이는 매우 큽니다 (
 EN = 2.5) 결과적으로 NaObond의 전자는 동일하게 공유되지 않습니다.
EN = 2.5) 결과적으로 NaObond의 전자는 동일하게 공유되지 않습니다.  이 전자는 전기 음성이 더 많은 산소 원자를 향해 끌어 당깁니다. 따라서 .NaOH는 물에 녹을 때 해리되어 Na + 및 OH- 이온을 제공합니다.
이 전자는 전기 음성이 더 많은 산소 원자를 향해 끌어 당깁니다. 따라서 .NaOH는 물에 녹을 때 해리되어 Na + 및 OH- 이온을 제공합니다. 
우리는 다음과 같은 경우 매우 다른 패턴을 얻습니다. 일반적인 비금속 수산화물 인 하이포 아 염소산 HOCl에 동일한 절차를 적용합니다.

여기에서 염소와 염소의 전기 음성도의 차이는 산소 원자는 작습니다 (
 EN = 0.28).결과적으로 ClObond의 전자는 두 원자가 어느 정도 동등하게 공유됩니다. 반면에 OHbond는 극성입니다 (
EN = 0.28).결과적으로 ClObond의 전자는 두 원자가 어느 정도 동등하게 공유됩니다. 반면에 OHbond는 극성입니다 ( EN = 1.24)
EN = 1.24)  이 결합의 전자는 전기 음성이 더 많은 산소 원자를 향해 끌립니다. . 이 분자가 이온화되면 O-Hbond의 전자가 산소 원자와 함께 남아 OCl- 및 H + 이온이 형성됩니다.
이 결합의 전자는 전기 음성이 더 많은 산소 원자를 향해 끌립니다. . 이 분자가 이온화되면 O-Hbond의 전자가 산소 원자와 함께 남아 OCl- 및 H + 이온이 형성됩니다. 
주기율표의 열을 가로 질러 금속에서 비금속으로의 갑작스러운 변화는 없습니다. 그러므로 우리는 금속과 비금속 산화물 또는 금속과 비금속 수산화물의 극단 사이에있는 화합물을 찾을 것으로 예상해야합니다. Al2O3 및 Al (OH) 3와 같은 이러한 화합물은 산 또는 염기로 작용할 수 있기 때문에 양쪽 성 (문자 그대로 “또는 둘 다”)이라고합니다. 예를 들어 Al (OH) 3는 염기와 반응 할 때 산으로 작용합니다.

반대로 작용합니다. 산과 반응 할 때 염기로 사용됩니다.


산과 염기의 Brnsted 정의
Brnsted 또는 Brnsted-Lowry 모델은 간단한 가정을 기반으로합니다. 산은 염기 역할을하는 다른 이온 또는 분자에 H + 이온을 기증합니다. 예를 들어 물의 해리는 한 물 분자에서 다른 물 분자로 H + 이온을 전달하여 H3O + 및 OH- 이온을 형성하는 것을 포함합니다.

이 모델에 따르면 HCl은 물에서 해리되어 H + 및 Cl + 이온을 형성하지 않습니다. 대신 H + 이온이 HCl에서 물 분자로 이동하여 H3O + 및 Cl- 이온을 형성합니다. 아래 그림입니다.


양성자이기 때문에 , H + 이온은 가장 작은 원자보다 몇 배 더 작기 때문에 분리 된 H + 이온의 전하는 작은 공간에 분산되어이 H + 이온이 용액에 존재하는 모든 음전하 소스로 끌려갑니다. , H + 이온이 생성되는 순간 i n anaqueous solution, 그것은 물 분자에 결합합니다. 따라서 H + 이온이 하나의 이온 분자에서 다른 분자로 전달되는 Brnsted 모델은 H + 이온이 비 수용액으로 존재한다고 가정하는 Arrhenius 이론보다 더 의미가 있습니다.
Brnsted 모델조차도 순진합니다. 산이 물에 제공하는 각각의 H + 이온은 아래 그림과 같이 4 개의 인접한 물 분자에 실제로 결합되어 있습니다.

산이 H + 이온을 잃을 때 생성되는 물질에 대한보다 현실적인 공식은 따라서 H (H2O) 4+입니다. H9O4 +. 그러나 모든 실제 목적에서이 물질은 H3O + 이온으로 나타낼 수 있습니다.
HCl과 물 사이의 반응은 Brnsted 산과 Brnstedbase의 정의를 이해하기위한 기초를 제공합니다. 이 이론에 따르면 H + 이온은 HCl이 물에서 분리 될 때 HCl 분자에서 물 분자로 전달됩니다.

HCl은 H +-역할을합니다. 이 반응에서 이온 공여체와 H2O는 H + 이온 수용체로 작용합니다. 따라서 Brnsted 산은 염기에 H + 이온을 제공 할 수있는 모든 물질 (예 : HCl)입니다. Brnsted 염기는 산에서 H + 이온을 받아 들일 수있는 물질 (H2O 등)입니다.
H + 이온의 이름을 지정하는 방법에는 두 가지가 있습니다. 어떤 화학자들은 이것을 수소 이온이라고 부릅니다. 다른 이들은 그것을 양성자라고 부릅니다. 결과적으로 Brnsted 산은 수소 이온 공여자 또는 양성자 공여자로 알려져 있습니다. Brnsted 염기는 수소 이온 수용체 또는 양성자 수용체입니다.
Brnsted 모델의 관점에서 볼 때 산과 염기 사이의 반응은 항상 양성자 기증자에서 양성자 수용체로의 H + 이온 전달을 포함합니다. 산은 중성 분자 일 수 있습니다.

양이온 일 수도 있습니다.

또는 음이온.

따라서 Brnsted 이론은 숫자를 확장합니다. 잠재적 산의. 또한 화학 공식에서 어떤 화합물이 산인지 결정할 수 있습니다. 산화수가 +1 인 수소를 포함하는 모든 화합물은 산이 될 수 있습니다.Brnsted 산에는 HCl, H2S, H2CO3, H2PtF6, NH4 +, HSO4- 및 HMnO4가 포함됩니다.
Brnsted 염기는 Lewis 구조에서 식별 할 수 있습니다. Brnsted 모델에 따르면 염기는 수용 할 수있는 모든 이온 또는 분자입니다. 양성자. 이 정의의 의미를 이해하려면 원형 염기 인 OH- 이온이 어떻게 양성자를 받아들이는지 살펴보십시오.

H + 이온을 받아들이는 유일한 방법은 공유 결합을 형성하는 것입니다. 원자가 전자가없는 H + 이온에 공유 결합을 형성하려면 염기가 결합을 형성하는 데 필요한 두 전자를 모두 제공해야합니다. 따라서 비 결합 원자가 전자 쌍을 가진 화합물 만이 H +-이온 수용체 또는 Brnsted 염기로 작용할 수 있습니다.
예를 들어 다음 화합물은 모두 비 결합 전자 쌍을 포함하고 있기 때문에 모두 Brnstedbase로 작용할 수 있습니다.

Brnsted 모델은 하나 이상의 비 결합 원자가 전자 쌍을 포함하는 이온 또는 분자를 포함하도록 잠재적 염기 목록을 확장합니다. 염기의 Brnsted 정의는 너무 많은 이온과 분자에 적용되어 다음과 같은 물질을 계산하기가 거의 쉽습니다. 이러한 물질은 결합하지 않는 원자가 전자 쌍이 없기 때문에 Brnsted 염기가 될 수 없습니다.
실습 문제 2 :다음 중 Brnsted 산이 될 수있는 화합물은 무엇입니까? Brnsted 기지는 어느 것이 될 수 있습니까?
(a) H2O
(b) NH3
(c) HSO4-
(d) OH-
여기를 클릭하여 연습 문제 2에 대한 답을 확인하세요.

Brnsted 이론에서 물의 역할
Brnsted 이론은 산-염기 반응에서 물의 역할을 설명합니다.
- 물은 해리되어 이온을 형성합니다. 산으로 작용하는 한 분자에서 염기로 작용하는 다른 분자로 H + 이온을 전달합니다.
H2O (l) + H2O (l) 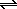
H3O + (aq) + OH- (aq) 산 기본 - 산은 H + 이온을 중성 물 분자에 기부하여 물과 반응하여 H3O + 이온을 형성합니다.
HCl (g) + H2O (l) 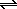
H3O + (aq) + Cl- (aq) 산 염기 - 염기는 물 분자에서 H + 이온을 받아 물과 반응하여 OH- 이온을 형성합니다.
NH3 (aq) + H2O (l) 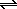
NH4 + (aq) + OH- (aq) 염기 산 - 물 분자는 산에서 H + 이온을 얻음으로써 산-염기 반응에서 중간체로 작용할 수 있습니다.
HCl (g) + H2O (l) 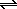
H3O + (aq) + Cl- (aq) 및 그런 다음이 H + 이온을베이스로 잃습니다.
NH3 (aq) + H3O + (aq) 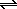
NH4 + (aq) + H2O (l) Brnsted 모델은 다른 용매에서 산-염기 반응으로 확장 할 수 있습니다. 예를 들어, 액체 암모니아에는 H + 이온이 NH3 분자에서 다른 NH4 + 및 NH2- 이온을 형성하기 위해 다른 NH3 분자로 이동하는 경향이 적습니다.
2 NH3 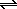
NH4 + + NH2- 수용액의 화학과 유사 함 , 액체 암모니아의 산은 NH4 + 이온의 모든 소스를 포함하고 염기는 NH2- 이온의 모든 소스를 포함한다는 결론을 내립니다.
Brnsted 모델은 용액에서 발생하지 않는 반응으로 확장 될 수도 있습니다. 가스상 산-염기 반응의 전형적인 예는 농축 염산과 수성 암모니아의 열린 용기를 나란히 놓을 때 발생합니다. . 염화 암모늄의 흰 구름은 한 용액에서 빠져 나온 HCl 가스가 다른 용액의 NH3 가스와 반응하면서 곧 형성됩니다.
HCl (g) + NH3 (g) 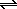
NH4Cl (s) 이 반응에는 H + 이온이 HCl에서 NH3로 이동하므로 Brnsted 산-염기 반응입니다. 비록 기체상에서 발생하더라도.
