Az empirikus bizonyítékok tisztázzák a kockázati tényezőket, az okokat és az első vonalbeli beavatkozásokat.
Jeffrey R. Strawn, MD
Klinikai pszichiátriai oktató, pszichiátriai tanszék, Cincinnati Egyetem Orvostudományi Főiskola
Dr. Paul E. Keck, ifjúsági tanár | Pszichiátria professzor, a Cincinnati Egyetem Orvostudományi Főiskola pszichiátriai tanszékének elnöke és vezérigazgatója, Lindner HOPE Központ, Cincinnati, OH
Stanley N. Caroff, MD
pszichiátria professzor, Pennsylvaniai Egyetem Orvostudományi Egyetem pszichiátriai tanszékének vezetője, fekvőbeteg-pszichiátria, pszichiátriai szolgálat vezetője, Philadelphia VA Medical Központ
A neuroleptikus malignus szindróma (NMS) diagnosztizálása és kezelése ellentmondásos, mert ez a potenciálisan életveszélyes szindróma ritka, és megjelenése eltérő. Ezek a tényezők megnehezítik a kezelések értékelését kontrollált klinikai vizsgálatokban, és a specifikus beavatkozások relatív hatékonyságáról kevés adat áll rendelkezésre. Lehetséges azonban racionális kezelési irányelvek kidolgozása empirikus klinikai adatok felhasználásával.1,2
Ez a cikk az NMS diagnózisának és kezelésének 6 ellentmondásos aspektusával kapcsolatos bizonyítékokat vizsgálja:
• a legmegbízhatóbb kockázati tényezők
• NMS mint spektrum zavar
• mi okozza az NMS-t
• Az első generációs és a második generációs antipszichotikumok által kiváltott NMS
• első vonalbeli beavatkozások
• az antipszichotikumok újraindítása egy NMS epizód után.
VANAK MEGBÍZHATÓ KOCKÁZATI TÉNYEZŐK NMS esetén?
Kis esetekkel kontrollált vizsgálatokban az agitáció, a dehidráció és a kimerültség voltak a legkövetkezetesebben megállapított szisztémás tényezők, amelyekről úgy gondolják, hogy az antipszichotikumokat az NMS-re hajlamosító betegek 1) .3-5 A katatonia és az organikus agyi szindrómák különálló rizikófaktorok lehetnek. 8 Farmakológiai vizsgálatok szerint nagyobb dózisok, gyors titrálás és Az antipszichotikumok IM-injekciói megnövekedett NMS-kockázattal járnak. 3,5 Egyes tanulmányok szerint az NMS-betegek 15% -ától 20% -áig szerepelnek NMS-epizódok.1,2 Ezenkívül nagy hatású első generációs antipszichotikumok (FGA) – különösen a haloperidolt – feltételezik, hogy nagyobb kockázatot hordoz, mint az alacsony hatású gyógyszerek és a második generációs antipszichotikumok (SGA-k), bár ezt a hipotézist továbbra is nehéz bizonyítani. 9-11
Ezek a kockázati tényezők azonban nem praktikusak az NMS kockázatának becsléséhez egy adott betegnél, mert viszonylag gyakoriak az NMS előfordulásának alacsony kockázatához képest. A pszichotikus tünetekkel küzdő betegek túlnyomó többsége számára a megfelelően jelzett antipszichotikus farmakoterápia előnyei meghaladják a kockázatokat.
1. Táblázat Mi növeli az NMS kockázatát?
- Keverés
- Kiszáradás
- Kimerülés
- Alacsony szérum-vas-koncentráció (normál: 60–170 mcg / dL)
Diagnosztizál
- Az NMS kórtörténete
- Catatonia
- Szerves agyi szindrómák
Központi idegrendszer
- Dopamin receptor diszfunkció
- Basal ganglion diszfunkció
- Szimpatikus idegrendszer diszfunkció
Farmakológiai kezelés *
- intramuszkuláris vagy intravénás injekciók
- nagy hatásfokú dopamin antagonisták
- gyors dózistitrálás
- nagy dózisok
- FGA-k az SGA-khoz (?)
* Az egyes betegeknél ezeket a gyakori kockázati tényezőket újra mérlegelni kell az antipszichotikus terápia előnyeivel
FGA-k: először generációs antipszichotikumok;
SGA-k: második generációs antipszichotikumok; NMS: malignus neuroleptikus szindróma
Forrás: 1-5. Hivatkozások
AZ NMS KAPCSOLATBAN PARKINSONIZMUSZ, CATATONIÁVAL VAGY MALIGNÁLÓ HIPERTERMIÁVAL kapcsolódik?
Parkinsonizmus. Egyes kutatók az NMS-t extrém parkinson-kórként írták le, amely az agy dopamin-útvonalainak elsöprő blokkolásából ered. 1,2, 12 Ebben a nézetben az NMS hasonlít a parkinson-hipertermia szindrómához, amely a Parkinson-kórban szenvedő betegeknél fordulhat elő hirtelen abbahagyás vagy elvesztés után. A dopaminerg terápia hatékonysága, amelyet a dopaminerg szerek visszahelyezésével lehet kezelni.13 Ezt a nézetet alátámasztó bizonyítékok a következőket tartalmazzák:
• A Parkinson-kór jelei az NMS egyik alapvető jellemzője.
• A dopamin-agonisták visszavonása kiváltja a szindrómát.
• Minden kiváltó gyógyszer dopamin receptor antagonista.
• Az NMS kockázata összefügg a gyógyszerek dopamin receptor affinitásával.
• A dopaminerg agonisták hatékony kezelést jelenthetnek.
• A dopaminerg utak elváltozásai hasonló szindrómát eredményeznek.
• NMS-ben szenvedő betegeknél alacsony a cerebrospinalis folyadékkoncentrációja a homovanillinsav dopamin-metabolitnak.14
Catatonia. Fink és mtsai15 és mások 16-18. Meggyőzően azzal érveltek, hogy az NMS a gyógyszer által kiváltott rosszindulatú katatonia egyik formáját képviseli. Az ezt alátámasztó bizonyítékok a következők:
• A 2 rendellenesség neuropszichiátriai tünetekkel rendelkezik.
• A katatonikus jelek gyakoriak az NMS-ben.19
• A rosszindulatú catatonia és az NMS fiziológiai és laboratóriumi tünetekkel jár együtt.20
• Az antipszichotikumok visszaállítása mindkét állapotot súlyosbíthatja.
• Benzodiazepinek és elektrokonvulzív terápia (ECT) ) hatékony kezelés mindkét rendellenesség esetében. 15-18
Lee21 14 NMS-ben szenvedő betegnél vizsgálta a katatóniás jellemzők és a kezelési válasz kapcsolatát. A katatonikus tünetekkel küzdő betegek többsége a benzodiazepinekre reagált, míg azok közül senki sem, akinek katatonia nélkül extrapiramidális-hipertermikus megjelenése volt. Lee arra a következtetésre jutott, hogy az NMS heterogén, és előfordulhat olyan katatóniás és nem katatonikus formákban, amelyek kezelési reakciója eltér.
Malignus hipertermia. Egyes klinikusok összehasonlították az NMS-t az inhalációs anesztetikumok és a szukcinilkolin által okozott rosszindulatú hipertermiával.1,2 A bizonyítékok a következőket tartalmazzák:
• a merevség, a hipertermia és a hipermetabolizmus hasonló klinikai jelei
• hasonló fiziológiai és laboratóriumi tünetek, mint például a rabdomiolysis
• hipertermia a dantrolénre reagálva.
Bár a 2 megjelenése hasonló, a rosszindulatú hipertermia intraoperatív módon jelentkezik, és a vázizomzat kalcium-szabályozásának farmakogenetikai rendellenességét tükrözi. Ezenkívül a rosszindulatú hipertermia merevsége nem reagál a perifériás hatású izomlazítókra. Az NMS-ből?
Az NMS patofiziológiája összetett, és valószínűleg több központi és szisztémás útvonal és neurotranszmitter kölcsönhatását is magában foglalja. Amint azt a fentiekben leírtuk, meggyőző bizonyítékok arra utalnak, hogy a dopamin blokád központi szerepet játszik.12
A hipotalamuszban található dopamin blokkolás feltételezhetően hozzájárul a hőszabályozás meghibásodásához, és a nigrostriatalis rendszer blokádja valószínűleg hozzájárul az izmok merevségéhez és hipermetabolizmusához. Az elülső cinguláris-mediális orbitofrontális áramkör és a laterális orbitofrontális áramkör dopaminerg bemenetének elvesztése valószínűleg hozzájárul az NMS-ben észlelt mentális állapotváltozásokhoz és katatóniás jellemzőkhöz. 12
Néhány kutató azonban versengő vagy kiegészítő hipotéziseket javasolt. Például a Gurrera 23 azt javasolta, hogy azok a betegek, akik hajlamosak az NMS kialakulására, sérülékenyek legyenek egy hiperaktív és szabályozatlan szimpatikus idegrendszerrel szemben, és ez a tulajdonság – a dopamin-blokkoló szerek által kiváltott dopamin-rendellenességgel együtt – NMS-t eredményez. Más kutatók szerotonin-, norepinefrin-, gamma-aminovajsav- és glutaminerg mechanizmusokat vezettek be. 1,12,24,25
A FGAS VAGY az SGAS NÖVELNI VALÓSZÍNŰBB NEM?
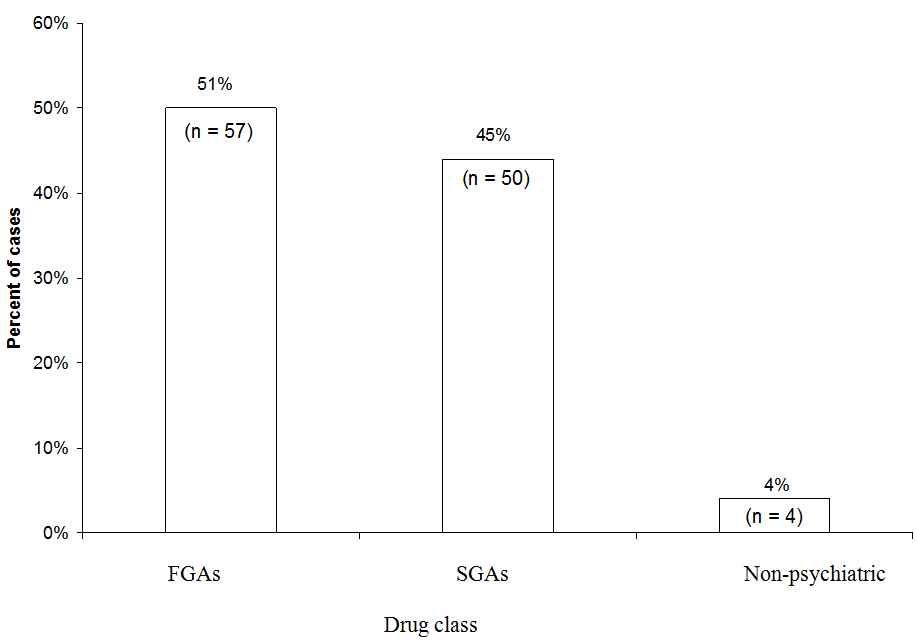
FGA: Első generációs antipszichotikumok
SGA: Második generációs antipszichotikumok
Kissé több NMS-esetet tulajdonítottak az FGA-knak (51%), mint az SGA-knak (45%) az NMS Hotline-nak 1997 és 2006 között bejelentett egyetlen gyógyszerrel kapcsolatos valószínű vagy határozott NMS 111 esetének elemzésében. Az FGA haloperidol 44% -ot tett ki az összes eset. Az “orvosi” azokra az esetekre utal, amikor egy neuroleptikumot nem pszichiátriai körülmények között alkalmaztak.
Forrás: A neuroleptikus rosszindulatú szindróma információs szolgálatának nyilvántartásba vett adatai.
Feltételezzük, hogy az NMS ritkábban fordul elő SGA-val kezelt betegeknél, mint azoknál, akik FGA-t kapnak, bár ez a hipotézis nem bizonyított. nehéz bizonyítani az FGA és az SGA felelősségét, mert:
• Az NMS ritka.
• Az adagolási gyakorlat konzervatívabb lehet, mint a múltban.
• A legtöbb klinikus tisztában van a betegség korai jeleivel. NMS.
Egy nagy adatbázis epidemiológiai vizsgálatában Stubner és mtsai 26 azt találták, hogy az SGA-kat kapó betegeknél alacsonyabb az NMS kockázata, mint a haloperidollal kezelteknél. 26 Ebben a vizsgálatban az NMS teljes aránya 0,02%.
NMS forródrót adatok. Nemrégiben megvizsgáltuk, hogy mely gyógyszercsoportok érintettek a rosszindulatú neuroleptikus S-nek bejelentett 111 NMS-es esetben yndrome Information Service forródrót (1-888-NMSTEMP) 1997 és 2006 között (ábra). Csak meghatározott vagy valószínű NMS-es eseteket vettünk fel (a hotline tanácsadók diagnosztizálták), amikor egyetlen antipszichotikumot adtak be. Valamivel több esetet tulajdonítottak az FGA-knak (51%), mint az SGA-knak (45%). A fennmaradó eseteket az orvosi körülmények között alkalmazott neuroleptikumoknak tulajdonították (például prometazint vagy proklorperazint).
Mivel ma már ritkábban írják fel őket, az FGA-k aránytalanul sok NMS-es esetet jelentettek a forródrótnak. A haloperidol az FGA esetek többségét és az esetek 44% -át tette ki. Ha kizártuk volna a haloperidolt, és az SGA-k NMS-kockázatát csak közepes vagy alacsony hatású FGA-val hasonlítottuk volna össze, akkor az SGA-k relatív előnye elveszett volna. Másrészt egyértelmű, hogy az SGA-k továbbra is kockázatot jelentenek az új tagállamokra nézve.
Elemzések azt sugallják, hogy az NMS SGA-val összefüggő klasszikus jellemzői – láz, izommerevség, valamint autonóm és mentális állapotváltozások – megmaradnak az SGA-ban részesülő betegeknél, bár egyeseknél nem alakulhat ki az FGA-ban részesülő betegeknél jellemző súlyos merevség és extrém hőmérséklet .9-11 Az SGA-khoz kapcsolódó enyhébb klinikai jellemzők konzervatívabb felírási mintákat, vagy az NMS fokozott tudatosságát és korábbi felismerését tükrözhetik, ami megakadályozná a fulmináns prezentációkat.
h2>
Az NMS ritka, megjelenése változó, progressziója kiszámíthatatlan. Ezek a tényezők megnehezítik a kezelések értékelését kontrollált klinikai vizsgálatokban, és a specifikus beavatkozások relatív hatékonyságáról kevés adat áll rendelkezésre.
Ennek ellenére az a felfogás, hogy az NMS a gyógyszer által kiváltott parkinsonizmus vagy katatonia szélsőséges változatát jelenti, arra utal, hogy a specifikus NMS a kezelések alapulhatnak a tünetek súlyosságán vagy a bemutatás szakaszán. Javaslunk egy kezelési útmutatót elméleti mechanizmusok és anekdotikus adatok alapján.2,27-29
Támogatás. A vétkes gyógyszer azonnali visszavonása után a szupportív terápia az NMS-kezelés sarokköve.1,2,27
Enyhe tünetekkel és tünetekkel küzdő betegek számára elegendő lehet a szupportív kezelés és a gondos klinikai monitorozás. Az extrém hipertermia mennyiségi újraélesztést és hűtési intézkedéseket, intenzív orvosi ellátást és a szövődmények gondos figyelemmel kísérését igényli. Annak ellenére, hogy nincs konszenzus a bonyolult NMS-ben alkalmazott gyógyszeres kezelésekkel kapcsolatban, az akut NMS-ben szenvedő betegek körülbelül 40% -a kap farmakológiai kezelést.
Az 1–2 mg parenterálisan alkalmazott Lorazepam ésszerű első vonalbeli kezelés az NMS-ben, különösen egyénekben katatóniás jellemzők.4,15-18,21,30,31 Egyes kutatók magasabb dózisokat javasolnak. 15 Benzodiazepinek előnyösek, ha nyugtatásra van szükség izgatott NMS-ben szenvedő betegeknél. 4,15-18
A dopaminerg szerek, például a bromokriptin és az amantadin fokozzák a dopaminerget átvitel fordított parkinson-kór tünetekre, és arról számoltak be, hogy csökkenti a gyógyulás idejét és felére csökkenti a halálozási arányt, ha önmagában vagy más kezelésekkel együtt alkalmazzák. 13,27,32,33 Ezen szerek gyors abbahagyása visszapattanási tüneteket eredményezhet, bár ez lehetséges igaz az NMS bármely specifikus gyógyszeres kezelésére. 1, 31, 32
A dantrolén elválasztja az gerjesztés-összehúzódás kapcsolását azáltal, hogy fokozza a vázizomzatban a szarkoplazmatikus retikulumban a kalcium szekvestrációt, és mi az NMS hipermetabolikus tüneteinek kezelésére. Egyes vélemények szerint a dantrolén monoterápiával kezelt NMS-betegek akár 80% -ánál javulást tapasztaltak. 27,32-35 A szupportív kezeléssel összehasonlítva a gyógyuláshoz szükséges idő csökkenhet – és a halálozás csaknem a fele csökkenhet -, ha a dantrolént önmagában vagy kombináció más gyógyszerekkel.
Nem minden esettanulmány igazolta, hogy a dantrolén, benzodiazepinek vagy dopaminerg agonisták hatékonyan kezelnék az NMS-t. 31,36 Véleményünk szerint csak a fejlett NMS-esetek – szélsőséges hőmérsékleti emelkedéssel, súlyos a merevség és a szisztémás hipermetabolizmus bizonyítékai – előnyösek a dantrolén kezeléssel kapcsolatban. 1, 2
Az ECT-t sikeresen alkalmazták az NMS és más katatón spektrumú rendellenességek okozta mortalitás csökkentésére. Általában a szupportív terápia után alkalmazzák, és a pszichofarmakológiai beavatkozások kudarcot vallanak. Az akut NMS esetében az 2,15, 16, 27, 37 ECT általában 6-10 kezelés sorozatából áll, kétoldalú elektróda elhelyezéssel. Kezdetben szükség lehet napi ECT-re. A betegek% -ánál fennállhat az NMS megismétlődésének kockázata, ha antipszichotikummal kezelik újra.1 A megfelelő óvintézkedések betartásával (2. táblázat) azonban biztonságosan kezelheti a legtöbb antipszichotikumot igénylő beteget.1,2
Amikor újraindítja a kezelést A korlátozott rendelkezésre álló adatok retrospektív elemzése szerint egy másik kémiai osztályba tartozó alacsonyabb hatású antipszichotikum biztonságosabb megoldás lehet, mint a kiváltó szer újrapróbálása. Az a beteg, akinek az NMS-je FGA-val alakul ki, részesülhet az SGA-vizsgálatból, bár fennáll a megismétlődés bizonyos kockázata.1,10
2. Táblázat: Antipszichotikumok újbóli bevezetése egy NMS-epizód után
Ellenőrizze az előző NMS-epizód diagnózisának pontosságát
Dokumentumjelzések antipszichotikus gyógyszerek esetén
Beszélje meg a beteggel és a családdal a kockázatokat és az előnyöket, ideértve a kiújulás kockázatát is.
Fontoljon meg alternatív farmakológiai szereket
A kockázati tényezők minimalizálása (1. táblázat)
Hagyjon ≥2 hetet (hosszú hatású injekciós gyógyszer esetén ≥4 hét), miután az NMS-epizód megszűnik, mielőtt újból feloldaná
Válasszon alacsony hatékonyságú FGA-kat vagy SGA-kat
Kezdeti tesztadag felírása
Az életjelek és a neurológiai állapot figyelése
Titrálás adagok fokozatosan
FGA-k: első generációs antipszichotikumok;
SGA-k: második generációs antipszichotikumok
Forrás: Referenciák 1,2
Kapcsolódó források
• Neuroleptikus malignus szindróma információs szolgáltatás. www.nmsis.org.
• Zarrouf FA, Bhanot V. Malignus neuroleptikus szindróma: még ne hagyja cserben őrét. Jelenlegi Pszichiátria 2007; 6 (8): 89-95.
Gyógyszer márkanevek
Amantadin • Symmetrel
brómokriptin • Parlodel
klórpromazin • Thorazin
Dantrolene • Dantrium® – Fluphenazin • Prolixin – Haloperidol • Haldol – Lorazepam • Ativan – Loxapine • Loxitane – Perphenazine • Trilafon – Prochlorperazine • Compazine, Compro
Promethazine • Phenergan
Tioridazin • Mellaril
Közzététel
Dr. Strawn az Amerikai Pszichiátriai Kutatási és Oktatási Intézet (APIRE) / Janssen Scholar.
Dr. Keck az Abbott Laboratories, az American Diabetes Association, az AstraZeneca Pharmaceuticals, a Bristol-Myers Squibb, a GlaxoSmithKline, az Eli Lilly and Company, a Janssen Pharmaceutica, az Országos Mentális Egészségügyi Intézet, az Országos Kábítószer-visszaélési Intézet, a Pfizer tanácsadójaként dolgozott vagy tanácsadóként dolgozott. , A Stanley Orvosi Kutatóintézet és az UCB Pharma.
Dr. Caroff kutatási támogatást kapott a Bristol-Myers Squibb, az Ortho-McNeil Neurologics és a Pfizer részéről.
- Caroff SN. Neuroleptikus malignus szindróma. In: Mann SC, Caroff SN, Keck PE Jr, Lazarus A, szerk. Neuroleptikus malignus szindróma és a kapcsolódó állapotok 2. kiadás Washington, DC: American Psychiatric Publishing Inc.; 2003; 1-44.
- Strawn JR, Keck PE Jr, Caroff SN. Neuroleptikus malignus szindróma Am J Psychiatry 2007; 164: 870–6.
- Keck PE Jr., HG Hope pápa, Cohen BM és mtsai. A malignus neuroleptikus szindróma kockázati tényezői Arch Gen Psychiatry 1989; 46: 914–18.
- Rosebush PI, Stewart TD. A malignus neuroleptikus szindróma 24 epizódjának prospektív elemzése Am J Psychiatry 1989; 146: 717–25.
- Berardi D, Amore M, Keck PE Jr és mtsai. A malignus neuroleptikus szindróma klinikai és farmakológiai rizikófaktorai: eset-kontroll vizsgálat. Biol Psychiatry 1998; 44: 748–54.
- White DA, Robins AH. Catatonia: a rosszindulatú neuroleptikus szindróma hírnöke Br J Psychiatry 1991; 158: 419–21.
- Rosebush PI, Mazurek MF. Szérum vas és rosszindulatú neuroleptikus szindróma. Lancet 1991; 338: 149–51.
- Lee JW. Szérum vas katatonia és neuroleptikus malignus szindróma esetén Biol Psychiatry 1998; 44: 499–507.
- Ananth J, Parameswaran S, Gunatilake S és mtsai. Neuroleptikus malignus szindróma és atipikus antipszichotikus gyógyszerek J Clin Psychiatry 2004; 65: 464–70.
- Caroff SN, Mann SC, Campbell EC. Atípusos antipszichotikumok és malignus neuroleptikus szindróma Psychiatr Ann 2000; 30: 314–21.
- Hasan S, Buckley P. Újszerű antipszichotikumok és a rosszindulatú neuroleptikus szindróma Am J Psychiatry 1998; 155: 1113–16.
- Mann SC, Caroff SN, Fricchione G, Campbell EC. Központi dopamin hipoaktivitás és a rosszindulatú neuroleptikus szindróma patogenezise Psychiatr Ann 2000; 30: 363–74.
- Factor SA, Santiago A. Parkinsonizmus-hyperpyrexia szindróma Parkinson-kórban. In: Frucht SJ, Fahn S, szerk. . Mozgászavaros vészhelyzetek: diagnózis és kezelés. Totowa, NJ: Humana Press; 2005; 29-40.
- Nisijima K, Ishiguro T. A monoamin-metabolitok és a gamma-amino-vajsav cerebrospinális folyadékszintje malignus neuroleptikus szindrómában. J Psychiatr Res 1995; 27: 233–44.
- Fink M, Taylor MA. A rosszindulatú neuroleptikus szindróma rosszindulatú katatonia, amely indokolja a katatonia hatékony kezelését. Prog Neuropsychopharmacol Biol Psychiatry 2006; 30: 1182–3.
- Fricchione G, Bush G, Fozdar M és mtsai. A katatonikus szindróma felismerése és kezelése. J Intensive Care Med 1997; 12: 135–47.
- Philbrick KL, Rummans TA. Malignus catatonia. J Neuropsychiatry Clin Neurosci 1994; 6: 1–13.
- Mann SC, Caroff SN, Bleier HR és mtsai. Halálos katatonia. Am J Psychiatry 1986; 143: 1374–81.
- Koch M, Chandragiri S, Rizvi S és mtsai. Katatonikus jelek rosszindulatú neuroleptikus szindrómában. Compr Psychiatry 2000; 41: 73–5.
- Lee JW. Laboratóriumi eredmények. In: Caroff SN, Mann SC, Francis A, Fricchoine GL, szerk. Catatonia: a pszichopatológiától a neurobiológiáig Washington, DC: American Psychiatric Press, Inc; 2004; 65-75.
- Lee JW.Katatonikus változatok, hipertermikus extrapiramidális reakciók és a rosszindulatú neuroleptikus szindróma altípusai. Ann Clin Psychiatry 2007; 19: 9–16.
- Caroff SN, Rosenberg H, Mann SC és mtsai. Neuroleptikus malignus szindróma perioperatív körülmények között. Am J Anesthesiol 2001; 28: 387–93.
- Gurrera RJ. Sympathoadrenalis hiperaktivitás és a malignus neuroleptikus szindróma etiológiája. Am J Psychiatry 1999; 156: 169–80.
- Carroll BT. A katatonia és a rosszindulatú neuroleptikus szindróma univerzális terepi hipotézise. CNS Spectr 2000; 5: 26–33.
- Weller M, Kornhuber J. A malignus neuroleptikus szindróma NMDA receptor antagonista terápiájának indoklása. Med Hypotheses 1992; 38: 329–33.
- Stubner S, Rustenbeck E, Grohmann R et al. Súlyos és nem gyakori akaratlan mozgászavarok a pszichotrop gyógyszerek miatt. Pharmacopsychiatry 2004; 37 (1. kiegészítés): S54 – S64.
- Davis JM, Caroff SN, Mann SC. Malignus neuroleptikus szindróma kezelése. Psychiatr Ann 2000; 30: 325–31.
- Adityanjee PA, Singh S, Singh G, Ong S. A malignus neuroleptikus szindróma spektrumkoncepciója. Br J Psychiatry 1988; 153: 107–11.
- Woodbury MM, Woodbury MA. Neuroleptikus indukálta katatonia, mint a rosszindulatú neuroleptikus szindróma felé haladás szakasza. J Am Acad Child Adolesc Psychiatry 1992; 31: 1161–4.
- Francis A, Chondragivi S, Rizvi S és mtsai. A lorazepam a rosszindulatú neuroleptikus szindróma kezelésére szolgál? CNS Spectr 2000; 5: 54–7.
- Rosebush PI, Stewart T, Mazurek MF. A rosszindulatú neuroleptikus szindróma kezelése. A dantrolén és a bromokriptin hasznos kiegészítője a szupportív kezelésnek? Br J Psychiatry 1991; 159: 709–12.
- Sakkas P, Davis JM, Janicak PG, Wang ZY. A rosszindulatú neuroleptikus szindróma gyógyszeres kezelése. Psychopharmacol Bull 1991; 27: 381–4.
- Rosenberg MR, Green M. Neuroleptikus malignus szindróma: a terápiára adott válasz áttekintése. Arch Intern Med 1989; 149: 1927–31.
- Yamawaki S, Morio M, Kazamutsuri G és mtsai. A dantrolén-nátrium klinikai értékelése és hatékony alkalmazása malignus neuroleptikus szindrómában. Kiso-Rinsyou (Clinical Reports) 1993; 27: 1045–66.
- Tsutsumi Y, Yamamoto K, Matsuura S és mtsai. A rosszindulatú neuroleptikus szindróma kezelése dantrolén-nátrium alkalmazásával. Psychiatry Clin Neurosci 1998; 52: 433–8.
- Reulbach U, Dutsch C, Biermann T és mtsai. A malignus neuroleptikus szindróma hatékony kezelésének kezelése. Crit Care 2007; 11: R4.
- Troller JN, Sachdev PS. A rosszindulatú neuroleptikus szindróma elektrokonvulzív kezelése: az esetek áttekintése és jelentése. Aust N Z J Psychiatry 1999; 33: 650–9.
- HG pápa, Aizley HG, Keck PE Jr, McElroy SL. Malignus neuroleptikus szindróma: 20 eset hosszú távú nyomon követése. J Clin Psychiatry 1991; 52: 208–12.