A lantán kémiai elemet lantanidként és ritkaföldfémként osztályozzák. 1839-ben fedezte fel Carl G. Mosander.

Adatzóna
| Besorolás: | A lantán lantanid és ritkaföldfémek |
| Szín: | ezüstfehér |
| Atom súly: | 138.9055 |
| Állapot: | szilárd |
| Olvadáspont : | 1540 oC, 1813,2 K |
| Forráspont: | 2830 oC, 3103 K |
| Elektronok: | 57 |
| Protonok: | 57 |
| Neutronok a legelterjedtebb izotópban: | 82 |
| Elektronhéjak: | 2,8,18,18, 9,2 |
| Elektronkonfiguráció: | 5d1 6s2 |
| Sűrűség @ 20oC: | 6,16 g / cm3 |
További információ, többek között: Hő, Energia, Oxidáció,
Reakciók , Vegyületek, sugárzás, vezetőképesség
| Atomtérfogat: | 22,5 cm3 / mol |
| Szerkezet: | hcp: hatszögletű bezárva |
| Keménység: | 2,5 mohs |
| Fajlagos hőteljesítmény | 0,19 J g-1 K-1 |
| Fúziós hő | 6,20 kJ mol-1 |
| Porlasztási hő | 414 kJ mol-1 |
| Hő párologtatás | 400 kJ mol-1 |
| 1. ionizációs energia | 538,1 kJ mol-1 |
| 2. ionizációs energia | 1067 kJ mol-1 |
| 3. ionizációs energia | 1850 kJ mol-1 |
| Elektron affinitás | 50 kJ mol-1 |
| Minimális oxidációs szám | 0 |
| Min. általános oxidációs sz. | 0 |
| Maximális oxidációs szám | 3 |
| Max. általános oxidáció sz. | 3 |
| Elektronegativitás (Pauling-skála) | 1.1 |
| Polarizálhatóság kötet | 31,1 Å3 |
| Légreakció | erőteljes, w / ht ⇒ La2O3 |
| 15 M HNO3 reakciója | enyhe, ⇒ La (NO3) 3 |
| Reakció 6 M HCl | enyhe, ⇒ H2, LaCl3 |
| Reakció 6 M NaOH-val | nincs |
| oxid ( s) | La2O3 |
| Hidrid (ek) | LaH2, LaH3 |
| Klorid (ok) | LaCl3 |
| Atomsugár | 195 pm |
| Ionos sugár (1+ ion) | – |
| Ionos sugár (2+ ion) | – |
| Ionos sugár (3+ ion) | 117.2 pm |
| Ionos sugár (1-ion) | – |
| Ionos sugár (2-ion) | – |
| Ionos sugár (3-ion) | – |
| Hővezető képesség | 13,4 W m-1 K-1 |
| Elektromos vezetőképesség | 1,9 x 106 S m-1 |
| Fagyás / olvadáspont: | 1540 oC, 1813,2 K |

A lantánt számos alkalmazásban használják, például stúdióvilágításban, laptop akkumulátorok, fényképezőgép lencsék és hibrid autóakkumulátorok.
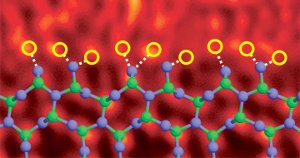
Szilícium-nitrid szemcsés határ adalékkal lantánatomokkal. Image Ref. (6)
Lantán felfedezése
A lantánt 1839-ben fedezte fel Carl G. Mosander a svédországi Stockholmban található ásványi ceritban.
A Ceria-t (cerium-oxidot) Jacob svéd kémikus már 1803-ban fedezte fel. Berzelius az ásványi ceritban. Mosander, aki Berzelius egyik tanítványa volt, azt gyanította, hogy a ceria tisztátalan oxid, amely más ritkaföldfémeket tartalmaz. (1)
Mosander finoman porított cérium-nitrátot vett és hideg, híg salétromsavat adott hozzá. A savban oldott cérium-nitrát por egy része új földet jelezhet. Az új oxid bázikusabb volt, mint a cérium (cérium-oxid), és a cériától eltérően a savban oldódott.
Mosander nátrium-oxalát és hő alkalmazásával elválasztotta az oldatot a csapadéktól. Megkapta az új ritka föld halvány tégla színű oxidját. (1)
Az új oxid lanthana nevét barátja, Berzelius javasolta.
A név a görög „lanthano” szóból származik, ami elrejtendő.
Axel Erdmann Mosanderrel egy évben önállóan fedezte fel a lantánt egy újonnan talált norvég ásványban. Erdmann Mosander tiszteletére mosandritának nevezte az új ásványi anyagot.(2)
Mosander tisztátalan fémlantánt nyert a kloridból. (1)
A tiszta lantánfémet először 1923-ban állították elő H. Kremers és R. Stevens olvasztott halogenidjeinek elektrolízisével.
Mosander folytatta a lantána tanulmányozását, és 1841-ben bejelentette a felfedezést. egy másik ritka földet tartalmaz. „Didymiumnak” nevezte el, mert úgy tűnt, hogy „a lanthanum elválaszthatatlan ikertestvére”. (2)
A „Didymium” később külön felfedezésekben ismeretlen ritkaföldfémek keverékének bizonyult. 1879-ben Lecoq de Boisbaudran szamáriumot mutatott ki a didymiumban, és elválasztotta tőle a szamáriumot. Carl Auer von Welsbach 1885-ben fedezte fel, hogy a megmaradt „didymium” valójában két teljesen új elem keveréke: a neodímium és a praseodímium.


A lantánt egyes medencetermékekben használják a tápláló foszfát tápanyagok szintjének csökkentésére. algák.

Az óramutató járásával megegyező irányban, fentről középre: Praseodymium, cerium, lanthanum, neodymium, samarium és gadolinium ritkaföldfém-oxidjai Fotó: LLNL
Megjelenés és jellemzők
Ártalmas hatások:
Lantán és vegyületei közepesen mérgezőnek számítanak.
Jellemzők:
A lantán ezüstfehér puha fém, amelyet késsel lehet levágni. , a képlékeny és kitett felületek gyorsan elszennyeződnek a levegőben, oxidot képezve.
A lantán vízzel reagálva lantán-hidroxidot és hidrogéngázt képez.
A lantán kémiailag reakcióképes és szénnel, nitrogénnel vegyületeket képez. , bór, szelén, szilícium, foszfor, kén és a halogének.
A lantán általában háromértékű ionként, La3 + -ként létezik vegyületeiben.
A lantán felhasználása
A lantánt nagy mennyiségben használják nikkelfém-hidrid (NiMH) újratölthető akkumulátorokban hibrid autókhoz. A NiMH akkumulátorokban található negatív elektróda (katód) fémhidridek keveréke – ezek egyike jellemzően a lantán-hidrid. A katód aktív anyaga a hidrogén, amelyet a fémhidrid szerkezet tárol. A fémhidrid összetételétől függően 1-7 tömeg% hidrogént tartalmazhat. (3) A Toyota Prius akkumulátorához körülbelül 10 kg lantán szükséges. (4)
A lantánt ásványolaj-krakkolási katalizátorként használják, amely katalizálja a hosszú láncú szénhidrogének rövidebb láncú fajokra történő felosztását.
A lantánt adalékként használják göbös öntöttvas és mint adalék acélban.
A lánggyújtó tűzkövek a lantánt tartalmazó huncut fémet (ritkaföldfém-ötvözet) használnak súrlódás céljából szikra előállításához. térfogatú hidrogéngáz.
A lantánt éjjellátó szemüvegek (infravörös abszorbeáló üveg) készítéséhez is használják.
A kiváló minőségű fényképezőgépek és teleszkóp lencsék lantán-oxidot (La2O3) tartalmaznak magas törésmutatója és alacsony diszperziója.
A lantán-karbonátot a vese betegségben szenvedő betegek foszfátszintjének csökkentésére használják. (5)
A lantánvegyületeket egyes medencetermékekben is használják az algákból táplálkozó foszfát tápanyagok szintjének csökkentésére.
Bőség és izotópok
Bőséges földkéreg: 34 ppm tömegre, 5 ppm mólra
Bőséges naprendszer: 2 ppm súly, 0,01 milliomodrész molonként
Tiszta költség: 800 dollár / 100 g
Költség: ömlesztve: 100 g / dollár
Forrás: A lantán nem található ingyen a természetben. Főleg a monazit és a bastnaezit ásványi anyagaiban található meg. Kereskedelmi szempontból monazit homokból és bastnaezitből nyerik ki különféle komplex extrakciós technikák alkalmazásával. A tiszta lantánt a fluorid kalcium-fémes redukciójával nyerjük.
Izotópok: A lantánnak 31 izotópja van, amelyek felezési ideje ismert, tömegük 119 és 150 között van. Ezek közül az egyik stabil, 139La. A természetesen előforduló lantán a két 138La és 139La izotóp keveréke, természetes bősége 0,09%, illetve 99,91%.

Idézd ezt az oldalt
Online linkeléshez kérjük, másolja és illessze be az alábbiak egyikét:
<a href="https://www.chemicool.com/elements/lanthanum.html">Lanthanum</a>
vagy
<a href="https://www.chemicool.com/elements/lanthanum.html">Lanthanum Element Facts</a>
Ha ezt az oldalt egy tudományos dokumentumban szeretné idézni, kérjük, használja a következő MLA-kompatibilis idézetet:
"Lanthanum." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/lanthanum.html>.