Az információfeldolgozás elengedhetetlen a tudomány minden területén. A molekuláris biológiában a központi dogma, amelyet először Francis Crick (Crick, 1958, 1970) hozott létre, az élő sejtek klasszikus gerince, amely a sejtek osztódásától a halálig terjedő folyamatokat alapvetően hajtja végre a DNS, az RNS és a fehérje információs útvonalain keresztül. Pontosabban, a központi dogma leírja a szekvencia információ átadását a DNS replikációja során, az RNS-be való transzkripciót és a fehérjéket alkotó aminosavláncra történő transzlációt. Ugyanakkor azt is kijelenti, hogy az információ nem áramolhat fehérjéről fehérjére vagy nukleinsavra.
A szisztémás és nagy áteresztőképességű megközelítések megjelenése óta az elmúlt két évtizedben ezek a tág lépések, amelyek nem tartalmazzák összetett szabályozási részletek, intenzív vizsgálat alá kerültek. A hiányzó szabályozási jellemzők, mint például a DNS-korrektúra / javító mechanizmusok és az pre-mRNS alternatív splicingjei, számos közvetítő lépést vezetnek be. Ezek a további lépések megzavarják a dogma legfontosabb lépéseit, és valószínűleg megváltoztatják az információ dinamikáját. Emellett úgy tűnik, hogy az epigenetika vagy a kromatinszerkezetek, a DNS-metiláció és a hisztonmódosítások szerepe szintén ellentétes a dogma egyszerű útjaival (Shapiro, 2009; Luco és mtsai, 2011). A fehérje splicingje vagy egy fehérje (inteinek) képessége a saját szekvenciájának megváltoztatására, amelyet a közelmúltban fedeztek fel (Volkmann és Mootz, 2012), valamint a más fehérjeszekvenciákat módosító prionok (Prusiner, 1998) megkerülik a fehérje információátviteli útvonalát dogma. Más vizsgálatok hibákról vagy eltérésekről számoltak be az RNS-szekvenciák és azok kódoló DNS-e között (Hayden, 2011; Li et al., 2011). Összességében ezek az adatok kétségbe vonják a központi dogma érvényességét a mai tudomány összefüggésében, ezért megkérdőjelezik a lineáris információáramlás (DNS-RNS és RNS-fehérje) egyszerűségét.
A dolgok perspektívába helyezéséhez elemző eszközökre van szükségünk, amelyek megvizsgálják a régóta fennálló elmélettel kapcsolatos aggályokat vagy eltéréseket. A globális tulajdonságok keresése a nagy áteresztőképességű adathalmazokban egy egyszerű, ugyanakkor nagyon hasznos technika a statisztikai korreláció-elemzés, amelyet széles körben és sikeresen alkalmaztak olyan összetett rendszerek mintáinak megfigyelésére, mint az időjárás (Stewart, 1990), a tőzsdék (Lo és MacKinlay). (1988) és a kozmológia (Amati et al., 2008). Többféle korrelációs elemzés létezik, amelyek mind a lineáris (pl. Pearson-termék-pillanat), mind a nem lineáris (pl. Spearman rangja, kölcsönös információ) függőségeket értékelik (Steuer et al., 2002; Rosner, 2011). , a Pearson termék-pillanat korrelációs elemzése vált a legnépszerűbbé, mivel képes a szervezeti struktúrát a legegyszerűbb formában bemutatni.
A biológiában számos olyan munka született, amely az mRNS összefüggéseit tanulmányozta, és fehérje expressziós adatok (lásd alább és az 1. táblázatot). Elméletileg, ha két nagydimenziós (például mikroarray és proteom) adatot tartalmazó mintát hasonlítunk össze, a korrelációs elemzések az egységtől való eltérés mértékét szolgáltatják mint a minták közötti különbség forrását. Röviden, két azonos és teljesen nem azonos információval ellátott minta az egység (R2 = 1) és a null (R2 = 0) összefüggést mutatja.
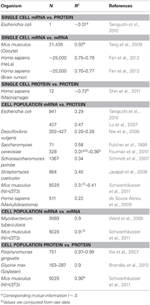
1. táblázat: mRNS és fehérje ession összefüggések különböző organizmusokban.
A tökéletes korreláció (R2 = 1) egy idealizált helyzet, amely messze van a valóságtól, mivel technikai vagy a kísérleti zaj önmagában zavarja és csökkenti a korrelációt. Az elmúlt évek ráadásul rávilágítottak a biológiai zaj létezésére: az egyes sejteken és molekulákon végzett vizsgálatok sztochaszticitást mutattak ki a génexpressziós dinamikában az alacsony molekuláris kópiaszámok kombinatorikus hatása és a promoter dinamika kvantális jellege miatt (Raj és van Oudenaarden, 2009; Eldar és Elowitz, 2010). Másrészt a sejtek klonális populációi heterogenitást mutatnak az adott fehérje expresszió szintjénként, sejtenként, bármikor (Chang és mtsai., 2008). A sztochaszticitás és a heterogenitás együttesen elengedhetetlen a sejtsors diverzifikációjának, a fenotípusos variációk és az intracelluláris jelek amplifikációjának előidézéséhez (Locke és mtsai., 2011; Selvarajoo, 2012).
A sztochasztikus ingadozások vagy a belső zaj okozza egy molekuláris faj expressziója időben és sejtenként változó lehet, ami korrelálatlan válaszokhoz vezet (Elowitz et al., 2002). Ez különösen szembetűnő az alacsony kópiaszámú mRNS-ek és fehérjék esetében. Így a minták (sejtek) közötti korreláció csökkenthető a belső zaj miatt (1A. Ábra). A külső tényezők által okozott biológiai zaj egyéb forrásai közé tartozik a sejtek méretének változékonysága, a molekuláris kópiaszám és az egyes sejtek közötti környezeti ingadozások.Ezek a tényezők torzítják a determinisztikus központi dogmát, és valószínűleg erős összefüggéseket változtatnak gyengébbekké (1B ábra).
Egy nemrégiben készült tanulmány összehasonlította az Escherichia coli mRNS-t és a fehérje expressziót az egyes sejtek között egyetlen molekula szinten, és olyan forgatókönyvet adott, amely mélyen megkérdőjelezi a központi dogmát. Taniguchi és mtsai. (2010) kimutatta, hogy nincs összefüggés (R2 ~ 0) az egyes tufA mRNS és az egyes sejtek fehérje szintje között. Nevezetesen arra a következtetésre jutottak, hogy a korreláció hiánya valószínűleg az mRNS és a fehérje élettartamának különbségei miatt következik be. Bár ez hihető magyarázat, Taniguchi és mtsai. vigyáztak arra, hogy ne cáfolják meg a régóta tartó hipotézist azzal az állítással, hogy az mRNS-szintek időátlagainak korrelálniuk kell a fehérjeszintekkel. Nem mutattak azonban bizonyítékot annak igazolására, hogy ez a tényleges eset, és amikor a nemlineáris függőségeket kölcsönös információk felhasználásával értékeltük (Steuer et al., 2002; Tsuchiya et al., 2010) Taniguchi et al. Adatkészlet, azt találtuk, hogy az eredmény nem függő, azaz I ~ 0. Ez megerősíti, hogy az mRNS és az egyes sejtek közötti fehérje-expresszió egyetlen molekula szinten egyértelműen nincs összefüggésben. Továbbá, amikor az egyes molekulák szintjén nagyítunk a korrelációs diagramban, nyilvánvaló, hogy páros korrelációik gyengék (1A ábra, beszúrás, szemléltetés céljából).
Különösen sejtpopulációs szinten Taniguchi et al. viszonylag magas korrelációt tudtak kimutatni az mRNS és a fehérje expresszió között R2 = 0,29 értékkel (2A. ábra). Valójában Lu és munkatársai egy másik független tanulmánya. (2007) az E. coli populáció esetében is viszonylag magas korrelációt mutatott (R2 = 0,47). Hasonló elemzéseket végeztek Saccharomyces cerevisiae-n (Futcher és mtsai, 1999), egér NIH / 3T3 fibroblaszton (Schwanhäusser és mtsai, 2011) és számos más sejtpopuláción (Nie és mtsai, 2006; Schmidt és mtsai, 2007; Jayapal és mtsai. al., 2008; de Sousa Abreu és mtsai, 2009) mindegyik korrelált struktúrát mutatott a transzkriptómra kiterjedő és a proteómra kiterjedő kifejezések között (1. táblázat). Tehát miért nincs összefüggés az egyes mRNS és a fehérje expressziók között az egyes sejtekben, míg populációs szinten kollektív összefüggések figyelhetők meg a nagyméretű mRNS és a fehérje expressziók között?
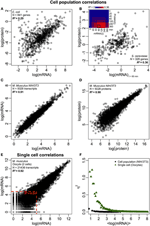
2. ábra Omics-szintű kifejezés összefüggései. Sejtpopulációk: mRNS-fehérje korrelációk (A) E. coliban (Taniguchi és mtsai., 2010) és (B) S. cerevisiae (Fournier és mtsai., 2010) az mRNS-expressziók t = 60 percnél és a fehérje-expressziók t-nél = 360 perc. Insert: az összes idõpont közötti korrelációs mátrix késleltetett növekedést mutat az mRNS és a fehérjék közötti korrelációkban. (C) mRNS és (D) fehérje expresszió egér NIH / 3T3 sejtek két mintája között (Schwanhäusser et al., 2011). Egyetlen sejtek: (E) mRNS expresszió két petesejt között (Tang et al., 2009). A piros pontozott vonalak jelzik az alacsony mRNS-expressziók régióit (log (mRNS) < 5). (F) Zaj (η2) versus log (mRNS expresszió) sejtpopuláció (NIH / 3T3, fekete pontok, Schwanhäusser és mtsai, 2011) és egysejtek (oociták, zöld háromszögek, Tang és mtsai, 2009) esetében. Minden pont a P = 100 mRNS-csoport értékét jelöli. η2 nulla közelében van az összes mRNS-expresszió sejtsejt populációjában. Egyetlen sejtek esetében az η2 a legalacsonyabb kópiaszámú mRNS-eknél a legmagasabb, és a magasabb kópiaszámoknál megközelíti a nullát.
Úgy gondoljuk két fő oka van a különbségeknek. Először is, amint azt korábban említettük, a zaj, akár biológiai, akár nem biológiai természetű, csökkenti az összefüggést. Mivel az egyes sejteken végzett elemzések megmutatták a sztochaszticitás és a variabilitás fontosságát, ezek a hatások döntő fontosságúak az egysejtes korrelációk csökkentésében. Az együttes szintjén, amikor a sejteket populációból veszik mintává, a teljes (belső + külső) zaj csökken, mivel a véletlenszerű zaj a molekuláris kifejezések minden tartományában kiürül (1C – F. Ábra), hogy kiderüljön az átlagos válasz és az önszerveződés ( Karsenti, 2008; Selvarajoo, 2011; Hekstra és Leibler, 2012; Selvarajoo és Giuliani, 2012). Ezért jó mértékű korreláció mutatkozik az mRNS-fehérje expresszióban. Másodszor, az egysejtű vizsgálat (Taniguchi és mtsai, 2010) során az egyes mRNS-fehérje expressziós korrelációt számos sejtben összehasonlították. Sejtpopulációs vizsgálatokban azonban az összehasonlítást teljes egészében elvégzik, több ezer mRNS és fehérje között, több nagyságrenddel nagyobb mértékben, mint a sejtek közötti egyetlen molekula esetében talált expressziós tartomány. Ez tehát magasabb korrelációhoz vezet populációs szinten, mivel az egyes molekuláris variációk hatása elhanyagolhatóvá válik.
Annak ellenére, hogy a sejtpopulációk esetében korrelációs struktúrákat figyeltek meg, kézzelfogható okai vannak a tökéletes korrelációtól való nagy eltérésnek.Mint korábban megjegyeztük, az egyik kulcsfontosságú pont az, hogy az mRNS-ek és a fehérjék egymás után, több hiányzó folyamat mellett helyezkednek el, a központi dogmában nem képviselve. A hiányzó köztitermékek biokémiai úton történő hozzáadásával az információáramlás észrevehető késleltetése következik be (Selvarajoo, 2006, 2011; Piras et al., 2011), és ennek következtében a közöttük fennálló összefüggés szenvedhet. Ez része lehet annak a ténynek is, amelyet Taniguchi et al. hogy az mRNS és a fehérje expressziójának élettartama eltér. Különösen ezt a posztulációt támasztja alá a Rapamicinnel kezelt S. cerevisiae nemrégiben végzett munkája, amely azt mutatta, hogy az mRNS-fehérje expressziójának időbeli összefüggései kezdetben alacsonyak voltak, R2 = 0,01 40 percnél, ennek ellenére a perturbáció után 360 perccel a korreláció nőtt, R2 = 0,36 (Fournier és mtsai, 2010, 2B. Ábra). Az adatok azt mutatják, hogy kémiai zavar esetén az mRNS és a fehérje expressziója közötti kezdeti válasz eltér az idő késleltetése és a közöttük lévő különböző kinetikai mechanizmusok, valamint olyan másodlagos hatások miatt, mint az autokrin vagy parakrin jelátviteli zavar (Shvartsman et al., 2002; Isalan és mtsai., 2008). Amikor a perturbáció hatása az idő múlásával gyengül, a korrelációk helyreállnak.
Annak további ellenőrzéséhez, hogy a szekvenciális késleltetési folyamatok vagy a különböző élettartamok döntő fontosságúak-e az mRNS-fehérje korrelációk csökkenésében, összehasonlítottuk az R2-t a a központi dogma ugyanazon molekuláris fajai (pl. az mRNS és az mRNS között) a sejtpopulációkban és az egyes sejtekben. Az NIH / 3T3 (Schwanhäusser és mtsai., 2011) (2C. Ábra) és a Mycobacterium tuberculosis (Ward et al., 2008) sejtpopulációs minták transzkriptómszintű mRNS-mRNS expressziójának korrelációja nagyon magas, R2 > 0,9 (1. táblázat). Ilyen szoros összefüggés figyelhető meg az NIH / 3T3 sejtekben a fehérje – fehérje expresszióra vonatkozó populációs mintákban (Schwanhäusser et al., 2011) (2D. Ábra), a Porphyromonas gingivalis (Xia és mtsai, 2007) és a Glycine max (Brandão és mtsai. , 2010) (1. táblázat). Mivel ezek az ugyanazokat a fajokat összehasonlító adatok nagyon magas korrelációkat eredményeznek, elképzelhető, hogy a szekvenciális késleltetési folyamatok vagy a különböző élettartamok felelősek azért, hogy az mRNS és a fehérje expressziója közötti populációszintbeli korrelációs struktúrák csökkennek.
Egyetlen egér petesejtekben ( Tang és mtsai., 2009) a teljes mRNS – mRNS expresszió összehasonlításakor erősen korrelált struktúra figyelhető meg (R2 = 0,92, 2E. Ábra). Azonban csak az alacsonyan expresszált mRNS-ekre összpontosítva (logaritmikus kifejezésekkel < 5), a sztochasztikus zaj meglehetősen drámai módon csökkenti a páronkénti korrelációt (R2 < 0,54). Ennek az eredménynek a vizsgálatához kiértékeltük a zajot, η2 = σ2XY / μ2XY, a teljes mRNS expresszióban (2F ábra). Megjegyeztük, hogy az η2 a legalacsonyabb kifejezéseknél a legmagasabb, a sztochasztikus ingadozások kifejezett hatása miatt, a kifejezéseikhez képest, és magasabb nulla esetén megközelíti a nulla értéket, ahol az ilyen zaj kevésbé jelentős (Piras et al., 2012). A sejtpopulációban a várakozásoknak megfelelően a teljes expressziós tartományban közel nulla zaj figyelhető meg a véletlenszerű zaj megszüntetése miatt (1E, F ábra).
A teljes mRNS – mRNS kifejezésekhez erősen korreláló struktúrák is társultak egyetlen rákos sejtről számoltak be (Fan és mtsai, 2012), bár kevésbé szignifikánsak R2 ~ 0,7 esetén (1. táblázat). Ezenkívül a fehérje-fehérje expresszió összehasonlítása az LPS-stimulált humán makrofágokban szintén magas korrelációt mutatott, R2 ~ 0,72 (Shin és mtsai, 2011) (1. táblázat). Habár nincs összefüggés az egyes sejtekben az egyes mRNS-fehérje expressziók között, az egyes sejtekben az azonos molekuláris fajok közötti nagymértékű vagy omics-szintű korreláció nagyon magas.
Így akár egyetlen sejt, akár sejtpopuláció , az omics egészére kiterjedő adatok azt mutatják, hogy az azonos molekuláris fajok (mRNS vs. mRNS és fehérje vs. fehérje) közötti összefüggések észrevehetően magasabbak, mint a különböző fajok (mRNS vs. fehérje) között. Ez azt a tényt tükrözi, hogy bár az idő-késleltetési folyamatok és az eltérő élettartam kulcsfontosságúak a korrelációk csökkentésében, ezek a mechanizmusok nem elegendőek ahhoz, hogy alátámasszák az egyes sejtek “fehérje-expresszióhoz való egyedi transzkripciója” közötti korrelációs struktúra hiányát.
Tehát a mRNS-ek és a különböző sejtrendszerek fehérjéinek nagymértékű expressziójának vizsgálatával kimutattuk, hogy a korrelációs struktúrák globális szinten jelennek meg, azonban a korrelációs elemzések csak két tesztelt minta összekapcsolhatóságát tárják fel, és nem mutatják a információáramlás. Ahhoz, hogy a központi dogma globális szinten érvényes legyen, az általános információáramlásnak a DNS-től a fehérjékig kell terjednie. Ilyen információáramlást számtalan más tanulmány bizonyított, amelyek a sejtpopulációk receptorainak megzavarásával és az eredmény nyomon követésével járnak. a DNS-hez kötődő transzkripciós faktorok dinamikája és nagyméretű génexpressziók indukciója (3A. ábra).Például az LPS-stimulált immunsejtek esetében bebizonyosodott, hogy az NF-κB transzkripciós faktor aktiválása körülbelül 15 percnél következik be (Liu et al., 1999), downstream génjeinek indukciója kb. perc (Liu és mtsai, 1999; Xaus és mtsai, 2000; Selvarajoo és mtsai, 2008), és a megfelelő fehérjék transzlációja 60–90 perc közötti tartományban (Kawai és mtsai, 1999; Xaus és mtsai. , 2000) (3B. Ábra). A transzláció információáramlásának teljes transzkripciójának ilyen szekvenciális irányát a baktériumrendszerek, például az E. coli esetében is megfigyelik sejtpopulációs szinten (Golding et al., 2005).

3. ábra: A központi dogma információáramlása. (A) Az LPS / TLR4 által kiváltott TNF expressziójának vázlata az NF-KB és a tnf gén transzkripciós faktor segítségével, lineáris információáramlást követve. (B) Az NF-KB (felső panelek), a tnf (középső panelek) és a TNF (alsó panelek) expresszió promóterkötő aktivitásának kísérleti időbeli profiljai sejtpopulációs szinten. (C) A promóterdinamika, az mRNS és a fehérje expressziójának sematikus profilja egysejtű szinten (Raj és van Oudenaarden, 2009).
Alternatív megoldásként az egysejtes felbontáson végzett vizsgálatok véletlenszerű ingadozásokat tárnak fel a lineáris információáramlás felett: a DNS-promóter régiókhoz kötődő transzkripciós faktorok mennyiségi jellegűek, ami az mRNS-transzkripció felszakadó viselkedését eredményezi, és ezután a fehérje transzlációjának változékonyságát váltja ki, még az azonos sejtek között is (3C. ábra) (Raj és van Oudenaarden, 2009; Eldar és Elowitz, 2010; Locke és mtsai, 2011; Hekstra és Leibler, 2012; Selvarajoo, 2012). Ennek eredményeként bármely adott időpontban az egyes sejtek egyéni molekuláris válasza meglehetősen zajos a populáció átlagos skálájához képest (Selvarajoo, 2011).
Következtetések
A példában bemutatott példák ez a tanulmány kiemeli a központi dogmában megfigyelt fajok közötti korrelációs értékek sorrendbeli különbségeit a sejtpopulációk és az egysejtek vonatkozásában. A sejtpopulációkból származó statisztikai elemzések olyan képet festenek, hogy az expressziós korreláció ugyanazon molekuláris fajok között nagyon magas, és a fajok között közepesen magas. Bár ugyanazon fajok közötti egysejt-korrelációk összehasonlíthatók a sejtpopulációkkal, a biológiai zaj kifejezett hatása miatt szélesebb szórást mutattak expressziós ábráikon, különösen az alacsony kópiaszámú transzkriptumok esetében. Nevezetesen, az egyes sejtek “páronkénti korrelációja nulla lesz az egyes molekulák esetében (Taniguchi és mtsai., 2010). Valójában a sztochasztikus ingadozások és a molekuláris expresszió változékonysága ismert, hogy funkcionális a sejtek sorsdöntésének előidézésében és a sejtek állapotának kibillentésében (Losick Desplan, 2008; Eldar és Elowitz, 2010; Kuwahara és Schwartz, 2012). Úgy gondoljuk, hogy az erős omékszintű összefüggések több ezer molekula közötti szoros gén- és fehérjeszabályozó hálózatok eredményeként jelentkeznek (Barabási és Oltvai, 2004; Karsenti , 2008) eredményeként átlagosan válaszokat kapunk. Kis számú vagy egyedi molekula elemzésével a korrelációs szerkezet nem figyelhető meg.
Összességében elképzelhető, hogy az egyetlen DNS fehérjébe történő információáramának megtekintése megkérdőjelezi a központi dogmát mivel az egyes molekulák egyetlen pillanatban adott válasza valószínűleg nem korrelál, globálisan azonban az átlagos determinisztikus válasz megfigyelése azt sugallja, hogy a genetikai nettó egyensúly Az információk az útvonalak jobb szélén maradnak. Ezért a központi dogmát makroszkopikus sejtszintű információáramlásként kell szemlélni az omika egész skáláján, és nem egyetlen géntől fehérje szintig. Mint ilyen, úgy gondoljuk, hogy egyszerűsége továbbra is az élő rendszerek egyik legbefolyásosabb elméleti pillére marad.
Összeférhetetlenségi nyilatkozat
A szerzők kijelentik, hogy a kutatás semmilyen kereskedelmi vagy pénzügyi kapcsolat hiánya, amely potenciális összeférhetetlenségként értelmezhető.
Köszönetnyilvánítás
Köszönetet mondunk Kentaro Hayashinak a megjegyzésekért. Tsuruoka város és Yamagata prefektúra kutatási alapja nagyra értékeli támogatását.
Crick, F. (1958). A fehérjeszintézisről. Symp. Soc. Exp. Biol. 12., 139–163.
Publikált absztrakt | Publikált teljes szöveg
Crick, F. (1970). A molekuláris biológia központi dogmája. Nature 227., 561–563.
Pubmed Abstract | Közzétett teljes szöveg
Hayden, E. C. (2011). A megváltozott RNS bizonyítékai vitát gerjesztenek. Nature 473, 432.
Pubmed Abstract | Közzétett teljes szöveg | CrossRef teljes szöveg
Hekstra, D. R. és Leibler, S. (2012). Készenléti és statisztikai törvények a mikrobiális zárt ökoszisztémák replikációjában. Cell 149, 1164–1173.
Pubmed Abstract | Közzétett teljes szöveg | CrossRef teljes szöveg
Kuwahara, H. és Schwartz, R. (2012).Sztochasztikus egyensúlyi nyereség gén expressziós folyamatban, mRNS degradáció szabályozással. J. R. Soc. 9. interfész, 1589–1598.
Pubmed Abstract | Közzétett teljes szöveg | CrossRef teljes szöveg
Nie, L., Wu, G. és Zhang, W. (2006). Az mRNS-expresszió és a fehérje-bőség összefüggése a transzlációs hatékonysággal kapcsolatos több szekvenciajellemző által befolyásolt Desulfovibrio vulgaris-ban: kvantitatív elemzés Genetika 174, 2229–2243.
Pubmed Abstract | Közzétett teljes szöveg | CrossRef teljes szöveg
Prusiner, S. B. (1998). Prionok. Proc. Natl. Acad. Sci. U.S.A. 95, 13363–13383.
Pubmed Abstract | Közzétett teljes szöveg | CrossRef teljes szöveg
Rosner, B. (2011). A biostatisztika alapjai. 7. Edn. Boston, MA: Duxbury Press.
Selvarajoo, K. (2006). Az autópályaszerű receptor 4 jelátviteli utak differenciálaktivációs mechanizmusainak felfedezése a MyD88 kiütésekben. FEBS Lett. 580, 1457–1464.
Pubmed Abstract | Közzétett teljes szöveg | CrossRef teljes szöveg
Selvarajoo, K. (2011). A megőrzés makroszkopikus törvénye feltárta az autópályaszerű receptor jelátvitel populációdinamikáját. Cell Commun. Jel. 9., 9.
Publikált absztrakt | Közzétett teljes szöveg | CrossRef teljes szöveg
Selvarajoo, K. (2012). A multimodális biológiai döntések megértése az egyetlen sejt és a populáció dinamikája alapján. Wiley Interdiscip. Tiszteletes Syst. Biol. Med. 4, 385–399.
Pubmed Abstract | Közzétett teljes szöveg | CrossRef teljes szöveg
Stewart, T. R. (1990). A korrelációs együttható bontása és felhasználása az előrejelzési készség elemzésében. Időjárás előrejelzés. 5, 661–666.