A nyomás és a térfogat kapcsolata: Boyle törvénye
A gáz nyomásának növekedésével a gáz térfogata csökken, mivel a gáz részecskék közelebb vannak szorítva egymáshoz. Ezzel ellentétben, amikor a gáz nyomása csökken, a gáz térfogata nő, mert a gázrészecskék mostantól távolabb mozoghatnak egymástól. Az időjárási léggömbök nagyobbak lesznek, amikor az atmoszférán keresztül alacsonyabb nyomású területekre emelkednek, mert a gáz térfogata megnőtt; vagyis a légköri gáz kisebb nyomást gyakorol a léggömb felületére, így a a belső gáz addig bővül, amíg a belső és a külső nyomás meg nem egyenlő.
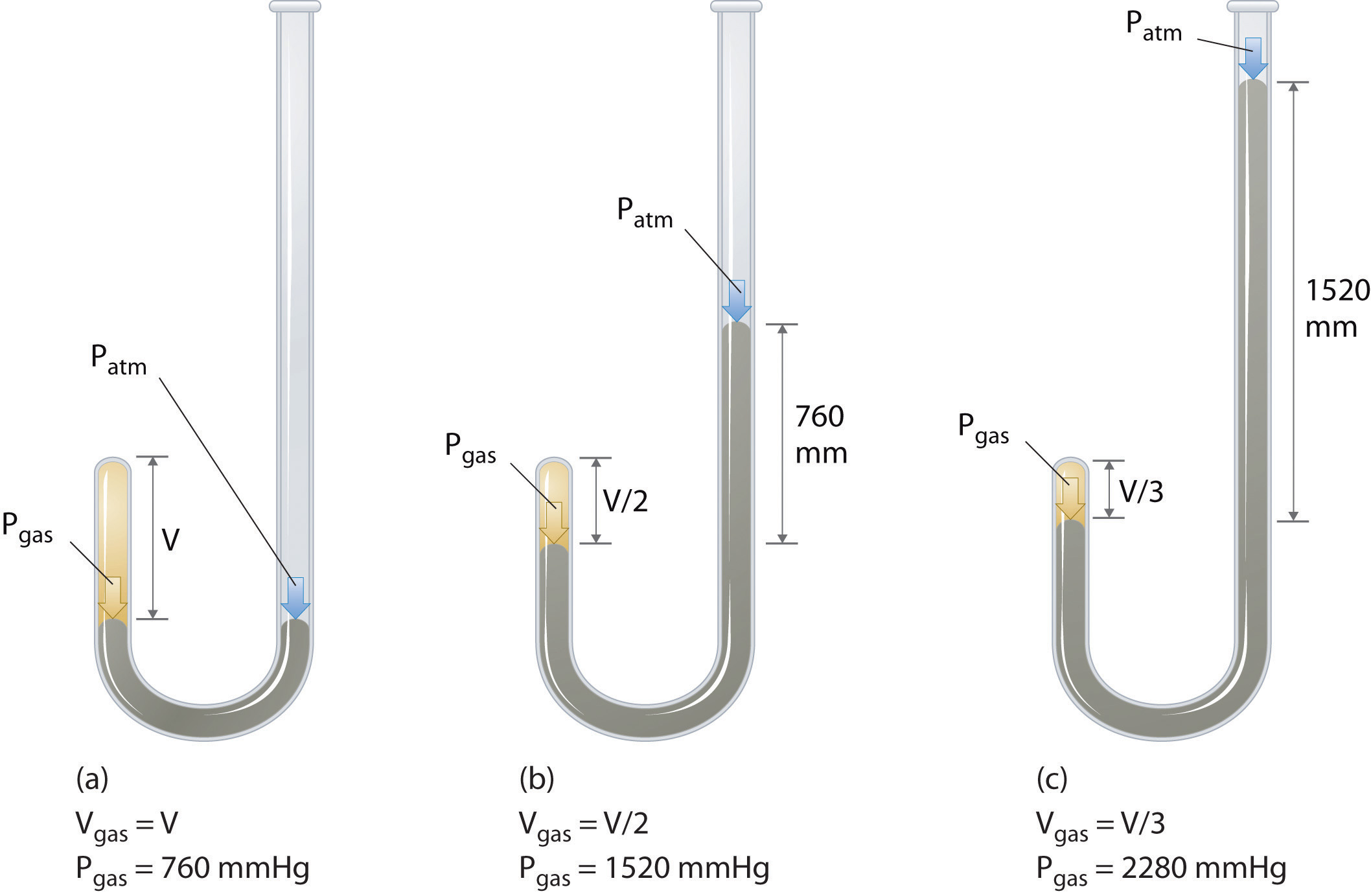
Robert Boyle ír kémikus (1627–1691) elvégezte a legkorábbi kísérleteket, amelyek meghatározták a nyomás és a térfogat közötti mennyiségi kapcsolatot. egy gáz. Boyle egy J alakú, részben higannyal töltött csövet használt, a \ (\ PageIndex {1} \) ábrán látható módon. Ezekben a kísérletekben kis mennyiségű gáz vagy levegő csapdába esik a higanyoszlop felett, és térfogatát légköri nyomáson és állandó hőmérsékleten mérik. Ezután több higanyt öntünk a nyitott karba, hogy növeljük a gázmintára nehezedő nyomást. A gáz nyomása a légköri nyomás plusz a higanyoszlopok magasságának különbsége, és az így kapott térfogatot megmérik. Ezt a folyamatot addig ismételjük, amíg vagy nincs hely a nyitott karon, vagy a gáz térfogata túl kicsi ahhoz, hogy pontosan meg lehessen mérni. Az olyan adatok, mint például Boyle saját kísérleteinek adatai, többféle módon ábrázolhatók (ábra \ (\ PageIndex {2} \)). Egy egyszerű \ (V \) versus \ (P \) diagram megadja a hiperbola nevű görbét, és felfedi az inverz kapcsolatot a nyomás és a térfogat között: amint a nyomás megduplázódik, a térfogat kétszerese csökken. A két mennyiség közötti kapcsolatot a következőképpen írják le:
\
Ha mindkét oldalt elosztjuk \ (P \) -vel, megadjuk az egyenletet, amely szemlélteti a \ (P \) és \ közötti inverz kapcsolatot. (V \):
\
vagy
\
ahol a ∝ szimbólum olvasható, “arányos.” A V kontra 1 / P kontúrja tehát egyenes, amelynek lejtése megegyezik a \ (\ ref {10.3.1} \) és \ (\ ref {10.3.3} \) egyenletben szereplő állandóval. A P (P helyett V) egyenlete \ (\ ref {10.3.1} \) hasonló összefüggést ad P és 1 / V között. Az állandó számértéke a kísérletben felhasznált gáz mennyiségétől és attól a hőmérséklettől függ, amelyen A nyomás és a térfogat közötti összefüggést felfedezője után Boyle törvényeként ismerjük, és a következőképpen állapítható meg: Állandó hőmérsékleten a fix mennyiségű gáz térfogata fordítottan arányos a nyomásával. törvény a gyakorlatban a \ (\ PageIndex {2} \) ábrán látható.
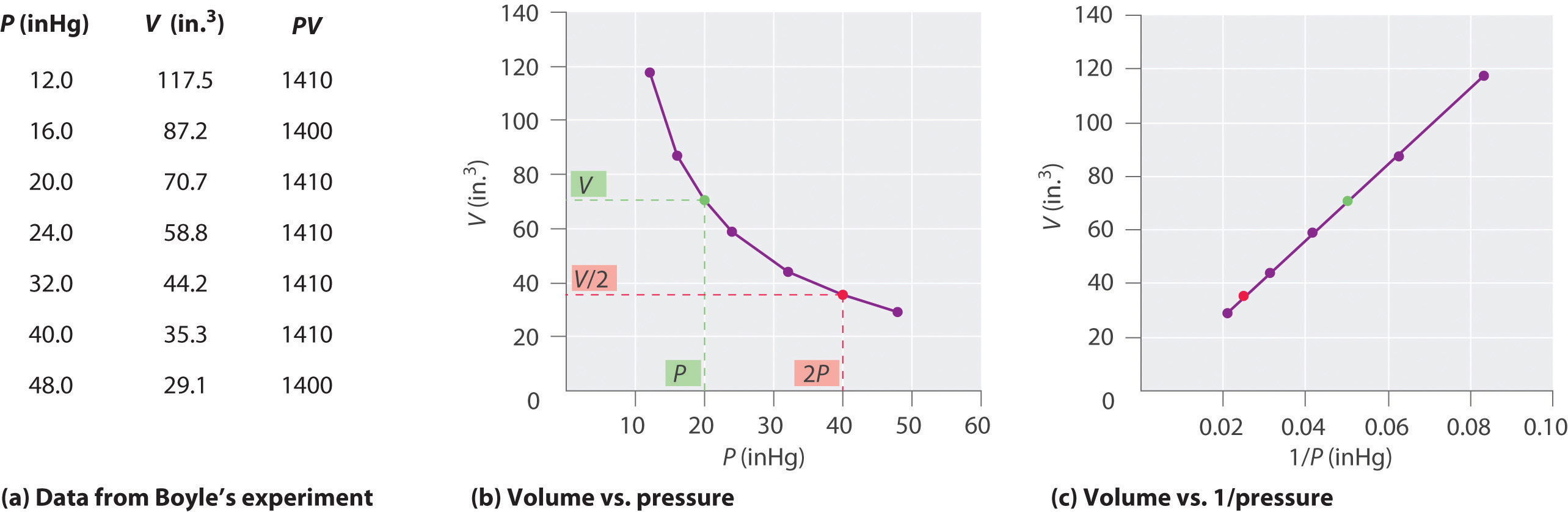
Állandó hőmérsékleten a rögzített mennyiségű gáz térfogata fordítottan arányos a nyomásával