Kemiallinen alkuaine lantaani luokitellaan lantanidiksi ja harvinaisten maametallien metalliksi. Sen löysi vuonna 1839 Carl G. Mosander.

tietovyöhyke
| Luokitus: | Lantaani on lantanidi ja harvinainen maametalli |
| Väri: | hopeanvalkoinen |
| Atomic paino: | 138.9055 |
| Tila: | kiinteä |
| Sulamispiste : | 1540 oC, 1813,2 K |
| Kiehumispiste: | 2830 oC, 3103 K |
| Elektronit: | 57 |
| Protonit: | 57 |
| Neutronit runsaimmalla isotoopilla: | 82 |
| Elektronikuoret: | 2,8,18,18, 9,2 |
| Elektronikonfiguraatio: | 5d1 6s2 |
| Tiheys @ 20oC: | 6,16 g / cm3 |
Näytä lisää, mukaan lukien: Lämmöt, energiat, hapettuminen,
reaktiot , Yhdisteet, säteet, johtavuus
| Atomimäärä: | 22,5 cm3 / mol |
| Rakenne: | hcp: kuusikulmainen tiivis pakattu |
| Kovuus: | 2,5 mohs |
| Ominaislämpökapasiteetti | 0,19 J g-1 K-1 |
| Fuusiolämpö | 6,20 kJ mol-1 |
| sumutuslämpö | 414 kJ mol-1 |
| höyrystyminen | 400 kJ mol-1 |
| 1. ionisaatioenergia | 538,1 kJ mol-1 |
| 2. ionisaatioenergia | 1067 kJ mol-1 |
| 3. ionisaatioenergia | 1850 kJ mol-1 |
| Elektroni-affiniteetti | 50 kJ mol-1 |
| Minimihapetusluku | 0 |
| Min. yleinen hapetusnro. | 0 |
| Suurin hapetusluku | 3 |
| Maks. yleinen hapetusnro. | 3 |
| Elektronegatiivisuus (Pauling-asteikko) | 1.1 |
| Polarisoitavuus määrä | 31,1 Å3 |
| Reaktio ilman kanssa | voimakas, w / ht ⇒ La2O3 |
| Reaktio 15 M HNO3: lla | lievä, ⇒ La (NO3) 3 |
| Reaktio 6 M HCl: llä | mieto, ⇒ H2, LaCl3 |
| Reaktio 6 M NaOH: lla | ei ole |
| oksidi ( s) | La2O3 |
| Hydridi (t) | LaH2, LaH3 |
| Kloridi (t) | LaCl3 |
| Atomisäde | 195 pm |
| Ionisäde (1+ ioni) | – |
| Ionisäde (2+ ionia) | – |
| Ionisäde (3+ ionia) | 117,2 pm |
| Ionisäde (1-ioni) | – |
| Ionisäde (2-ioni) | – |
| Ioninen säde (3-ioni) | – |
| Lämmönjohtavuus | 13,4 W m-1 K-1 |
| Sähkönjohtavuus | 1,9 x 106 S m-1 |
| Jäätymis- / sulamispiste: | 1540 oC, 1813,2 K |

Lantaania käytetään monissa sovelluksissa, kuten studio-valaistuksessa, kannettavien tietokoneiden akut, kameran linssit ja hybridiautojen akut.
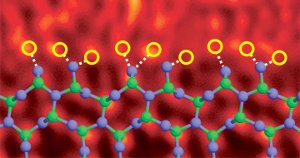
Piinitridin jyvien raja seostettu lantaaniatomien kanssa. Kuvan viite (6)
Lantaanin löytäminen
Carl G. Mosander löysi Lanthanumin vuonna 1839 mineraaliseretiitistä Tukholmassa, Ruotsissa.
Cerian (ceriumoksidi) oli löytänyt jo vuonna 1803 ruotsalainen kemisti Jacob Berzelius mineraaliseriteissä. Mosander, joka oli ollut yksi Berzeliusin opiskelijoista, epäili cerian olevan epäpuhdas oksidi, joka sisälsi muita harvinaisia maametalleja. (1)
Mosander otti hienoksi jauhettua ceriumnitraattia ja lisäsi kylmää laimeaa typpihappoa. Osa happoon liuotetusta seriumnitraattijauheesta saattaa osoittaa uutta maata. Uusi oksidi oli emäksisempi kuin ceria (ceriumoksidi) ja, toisin kuin ceria, liuotettiin happoon.
Mosander erotti liuoksen sakasta natriumoksalaatilla ja lämmöllä. Hän sai uuden harvinaisen maametallin vaalean tiilenvärisen oksidin. (1)
Uuden oksidin nimen lanthana ehdotti hänen ystävänsä Berzelius.
Nimi tulee kreikkalaisesta sanasta lanthano, joka tarkoittaa piilotettavaa.
Axel Erdmann löysi lantaanin itsenäisesti samana vuonna kuin Mosander äskettäin löydetystä norjalaisesta mineraalista. Erdmann kutsui uutta mineraalia mosandriitiksi Mosanderin kunniaksi.(2)
Mosander sai kloridista epäpuhdasta metallilantaania. (1)
Puhdasta lantaanimetallia tuotettiin ensimmäisen kerran vuonna 1923 H. Kremersin ja R. Stevensin sulatettujen halogenidien elektrolyysillä.
Mosander jatkoi lanthanan opiskelua ja ilmoitti löytöstään vuonna 1841. toisen siinä olevan harvinaisen maametallin. Hän antoi sille nimen ”didymium”, koska se näytti olevan ”erottamaton lantaanin kaksoisveli”. (2)
Myöhemmin erillisissä löydöksissä osoitettiin, että Didymium oli sekoitus tuntemattomia harvinaisten maametallien elementtejä. Vuonna 1879 Lecoq de Boisbaudran havaitsi samariumin didymiumista ja erotti samariumin siitä. Carl Auer von Welsbach huomasi vuonna 1885, että jäljellä oleva didymium oli oikeastaan kahden täysin uuden elementin: neodyymin ja praseodyymin sekoitus.


Lantaania käytetään joissakin poolituotteissa ruokkivan fosfaattiravinteiden määrän vähentämiseksi levät.

Myötäpäivään ylhäältä keskustasta: Praseodyymin, ceriumin, lantaanin, neodyymin, samariumin ja gadoliniumin harvinaiset maametallit. Kuva: LLNL
Ulkonäkö ja ominaisuudet
Haitalliset vaikutukset:
Lantaani ja sen yhdisteet pidetään kohtalaisen myrkyllisinä.
Ominaisuudet:
Lantaani on hopeanvalkoinen pehmeä metalli, joka voidaan leikata veitsellä.
Se on sitkeää muokattavat ja paljaat pinnat pilaantuvat nopeasti ilmassa muodostaen oksidin.
Lantaani reagoi veden kanssa muodostaen lantaanihydroksidia ja vetykaasua.
Lantaani on kemiallisesti reaktiivinen ja muodostaa yhdisteitä hiilen, typen kanssa. , boori, seleeni, pii, fosfori, rikki ja halogeenit.
Lantaania esiintyy tavallisesti kolmiarvoisena ionina, La3 +, sen yhdisteissä.
Lantaanin käyttö
Lantaania käytetään suurina määrinä ladattavissa nikkelimetallihydridiakkuissa (NiMH) hybridiautoissa. NiMH-paristojen negatiivinen elektrodi (katodi) on metallihydridien seos – joista yksi on tyypillisesti lantaanihydridi. Katodin aktiivinen materiaali on vety, jota varastoidaan metallihydridirakenteeseen. Metallihydridi voi koostumuksestaan riippuen pitää 1 – 7 painoprosenttia vetyä. (3) Toyota Prius -akku vaatii noin 10 kg lantaania. (4)
Lantaania käytetään öljykrakkauskatalysaattorina, joka katalysoi pitkäketjuisten hiilivetyjen hajoamista lyhyemmäketjuisiksi lajeiksi.
Lantaania käytetään lisäaineena nodulaarisen valuraudan ja teräksen lisäaineena.
Liekin sytyttimissä käytetään lantaania sisältävää väärämetallia (harvinaisten maametallien seos) kipinöiden tuottamiseksi kitkan kautta.
Lantaania käytetään vetysieniseoksissa, jotka kestävät jopa 400 kertaa omat. vetykaasun määrä.
Lantaania käytetään myös yönäkölasien (infrapunaa absorboivan lasin) valmistamiseen.
Laadukkaat kamera- ja kaukoputkiobjektiivit sisältävät lantaanioksidia (La2O3) sen korkea taitekerroin ja matala dispersio.
Lantaanikarbonaattia käytetään vähentämään veren fosfaattipitoisuutta munuaissairaudessa. (5)
Lantaaniyhdisteitä käytetään myös joissakin poolituotteissa vähentämään fosfaattiravinteiden määrää, josta levät syövät.
Runsaus ja isotoopit
Runsaasti maankuorta: 34 miljoonasosaa painosta, 5 miljoonasosaa moolina
Runsaasti aurinkokuntaa: 2 miljardia osaa paino, 0,01 miljardia osaa moolia kohti
Puhdas hinta: 800 dollaria per 100 g
Kustannus, irtotavarana: 100 dollaria per gramma
Lähde: Lantaania ei löydy ilmaiseksi luonnossa. Sitä esiintyy pääasiassa monatsiitin ja bastnaesiitin mineraaleissa. Kaupallisesti se otetaan talteen monatiittihiekasta ja bastnaesiitista käyttämällä erilaisia monimutkaisia uuttotekniikoita. Puhdasta lantaania saadaan pelkistämällä fluori kalsiummetallilla.
Isotoopit: Lantaanissa on 31 isotooppia, joiden puoliintumisaika on tiedossa, massanumerot 119-150. Näistä yksi on stabiili, 139La. Luonnossa esiintyvä lantaani on seos kahdesta isotoopista 138La ja 139La luonnollisten runsauksien ollessa 0,09% ja 99,91% vastaavasti.

Lainaa tätä sivua
Online-linkitystä varten kopioi ja liitä yksi seuraavista:
<a href="https://www.chemicool.com/elements/lanthanum.html">Lanthanum</a>
tai
<a href="https://www.chemicool.com/elements/lanthanum.html">Lanthanum Element Facts</a>
Jos haluat lainata tätä sivua akateemisessa asiakirjassa, käytä seuraavaa MLA-yhteensopivaa viittausta:
"Lanthanum." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/lanthanum.html>.