Tietojenkäsittely on välttämätöntä kaikilla tieteenaloilla. Molekyylibiologiassa keskeinen dogma, jonka ensiksi kehitti Francis Crick (Crick, 1958, 1970), on elävien solujen klassinen selkäranka, joka toteuttaa periaatteessa prosessit solujen jakautumisesta kuolemaan DNA-, RNA- ja proteiinitietoreittien kautta. Tarkemmin sanottuna keskeinen dogma kuvaa sekvenssitiedon siirtämistä DNA-replikaation aikana, transkriptio RNA: ksi ja translaation proteiineja muodostaviksi aminohappoketjuiksi. Samanaikaisesti siinä todetaan myös, että tieto ei voi kulkea proteiineista proteiineihin tai nukleiinihappoihin.
Systeemisen ja korkean suorituskyvyn lähestymistapojen tulon jälkeen viimeisten kahden vuosikymmenen aikana nämä laajat vaiheet, jotka eivät sisällä monimutkaiset sääntelyyn liittyvät yksityiskohdat, ovat olleet tiiviissä valvonnassa. Puuttuvat sääntelyominaisuudet, kuten DNA: n oikoluku / korjausmekanismit ja vaihtoehtoinen pre-mRNA: n silmukointi, esittävät useita välivaiheita. Nämä lisäaskeleet häiritsevät dogman tärkeimpiä vaiheita ja muuttavat todennäköisesti informaatiodynamiikkaa. Lisäksi epigeneettisyys tai kromatiinirakenteiden, DNA: n metylaation ja histonimodifikaatioiden rooli näyttää myös olevan vastoin dogman yksinkertaisia reittejä (Shapiro, 2009; Luco et ai., 2011). Viime aikoina löydetty proteiinin silmukointi tai proteiinin (inteiinien) kyky muuttaa omaa sekvenssinsä (Volkmann ja Mootz, 2012) ja muut proteiinisekvenssejä modifioivat prionit (Prusiner, 1998) ohittavat proteiinin tiedonsiirtoreitin dogma. Muut tutkimukset ilmoittivat virheistä tai ristiriitaisuuksista RNA-sekvenssien ja niiden koodaavan DNA: n välillä (Hayden, 2011; Li et ai., 2011). Yhdessä nämä tiedot herättävät epäilyksiä keskeisen dogman pätevyydestä nykyajan tieteen yhteydessä ja kyseenalaistavat siksi lineaarisen tiedonkulun (DNA: sta RNA: han ja RNA: sta proteiiniin) yksinkertaisuuden.
Asioiden perspektiiviin asettamiseksi tarvitsemme analyyttisiä työkaluja, jotka tutkivat pitkäaikaisen teorian huolenaiheita tai ristiriitoja. Yksi yksinkertainen, mutta erittäin hyödyllinen tekniikka globaalien ominaisuuksien etsimiseksi suuritehoisissa aineistoissa on tilastollinen korrelaatioanalyysi, jota on käytetty laajasti ja onnistuneesti monimutkaisten järjestelmien, kuten sään (Stewart, 1990), osakemarkkinoiden (Lo ja MacKinlay) mallien havainnoimiseksi. , 1988) ja kosmologia (Amati et ai., 2008). On olemassa useita erilaisia korrelaatioanalyyseja, joissa arvioidaan sekä lineaarisia (esim. Pearsonin tuotemomentti) että epälineaarisia (esim. Spearmanin sijoitus, keskinäinen tieto) riippuvuuksia (Steuer et al., 2002; Rosner, 2011). , Pearsonin tuotemomenttikorrelaatioanalyysi on tullut suosituin, koska sillä on kyky näyttää organisaatiorakenne yksinkertaisimmalla tavalla.
Biologiassa on ollut lukuisia teoksia, joissa on tutkittu korrelaatioita mRNA: ssa ja proteiiniekspressiotiedot (katso alla ja taulukko 1): Teoriassa, kun verrataan kahta näytettä, jotka sisältävät suuria ulottuvuuksia (kuten mikropiirre ja proteomi), korrelaatioanalyysit tarjoavat mittauksen poikkeamisesta yhtenäisyydestä näytteiden välisenä erona. Lyhyesti sanottuna kahdessa näytteessä, joissa on identtiset ja täysin ei-identtiset tiedot, näkyy vastaavuus yksikössä (R2 = 1) ja nolla (R2 = 0).
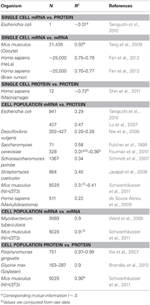
Taulukko 1. mRNA- ja proteiinilauseke ession korrelaatiot eri organismeissa.
Täydellinen korrelaatio (R2 = 1) on idealisoitu tilanne, joka on kaukana todellisuudesta, teknisenä tai kokeellinen melu yksin häiritsee ja vähentää korrelaatiota. Viime vuosina on lisäksi korostettu biologisen melun olemassaoloa: Yksittäisiä soluja ja molekyylejä koskevat tutkimukset ovat osoittaneet geeniekspressiodynamiikan stokastisuuden johtuen matalien molekyylikopiolukujen yhdistelmävaikutuksesta ja promoottorin dynamiikan kvantitatiivisesta luonteesta (Raj ja van Oudenaarden, 2009; Eldar ja Elowitz, 2010). Toisaalta solujen klonaalipopulaatioilla on heterogeenisyys tietyn proteiiniekspression tasoissa solua kohti milloin tahansa mitattuna aikana (Chang et ai., 2008). Stokastisuus ja heterogeenisuus ovat yhdessä välttämättömiä solun kohtaloiden monipuolistumisen, fenotyyppisten vaihteluiden ja solunsisäisten signaalien vahvistamisen aikaansaamiseksi (Locke et al., 2011; Selvarajoo, 2012).
Stokastiset vaihtelut tai sisäinen melu aiheuttavat molekyylilajin ilmentyminen vaihtelevat ajassa ja solujen välillä, mikä johtaa korreloimattomiin vasteisiin (Elowitz et ai., 2002). Tämä on erityisen merkittävää mRNA: iden ja proteiinien kohdalla, joiden kopiomäärä on pieni. Täten näytteiden (solujen) välistä korrelaatiota voidaan pienentää sisäisen melun vuoksi (kuva 1A). Muita ulkoisista tekijöistä johtuvia biologisen melun lähteitä ovat solukoon vaihtelut, molekyylikopioluvut ja yksittäisten solujen väliset ympäristön vaihtelut.Nämä tekijät vääristävät determinististä keskeistä dogmaa ja muuttavat todennäköisesti vahvat korrelaatiot heikommiksi (kuva 1B).
Eräässä tuoreessa tutkimuksessa verrattiin Escherichia coli -mRNA: ta ja proteiiniekspressiota yksittäisten solujen välillä yksittäisen molekyylin tasolla ja tarjottiin skenaario, joka kyseenalaistaa syvästi keskeisen dogman. Taniguchi et ai. (2010) paljasti, että yksittäisten tufA-mRNA- ja proteiinitasojen välillä ei ole korrelaatiota (R2 ~ 0). Erityisesti he päättelivät, että korrelaation puute johtuu todennäköisesti mRNA: n ja proteiinien elinaikojen eroista. Vaikka tämä on uskottava selitys, Taniguchi et ai. olivat varovaisia kumoamatta pitkäaikaisen hypoteesin väittämällä, että mRNA-tasojen keskiarvojen tulisi korreloida proteiinitasojen kanssa. Ei kuitenkaan ollut näyttöä sen osoittamiseksi, että tämä on todellinen tapaus, ja kun arvioimme epälineaarisia riippuvuuksia keskinäisen tiedon avulla (Steuer et al., 2002; Tsuchiya et ai., 2010) julkaisussa Taniguchi et ai. tietoaineistosta havaitsimme, että tulos ei ole riippuvainen, toisin sanoen I ~ 0. Tämä vahvistaa, että mRNA proteiinin ilmentymiseen yksittäisten solujen välillä yksittäisen molekyylin tasolla eivät ole selvästi yhteydessä toisiinsa. Lisäksi kun zoomataan yhden molekyylitason korrelaatiokaaviossa, on ilmeistä, että niiden parikohtaiset korrelaatiot ovat heikkoja (kuva 1A, insertti, havainnollistamiseksi).
Erityisesti solupopulaatiotasolla Taniguchi et. al. pystyivät osoittamaan suhteellisen korkean korrelaation mRNA: n ja proteiini-ilmentymien välillä, kun R2 = 0,29 (kuvio 2A). Itse asiassa toinen itsenäinen tutkimus Lu et al. (2007) osoittivat myös E. coli -populaation suhteen suhteellisen korkean korrelaation (R2 = 0,47). Samanlaiset analyysit, jotka on tehty Saccharomyces cerevisiaelle (Futcher et ai., 1999), hiiren NIH / 3T3-fibroblastille (Schwanhäusser et al., 2011) ja useille muille solupopulaatioille (Nie et ai., 2006; Schmidt et ai., 2007; Jayapal et ai. et ai., 2008; de Sousa Abreu et ai., 2009) osoittivat kaikki korreloivat rakenteet transkriptio- ja proteomilaajennusten välillä (taulukko 1). Joten miksi yksittäisten solujen yksittäisten mRNA- ja proteiini-ilmentymien välillä ei ole korrelaatiota, kun taas populaatiotasolla kollektiivisia suhteita havaitaan laajamittaisten mRNA- ja proteiini-ilmentymien välillä?
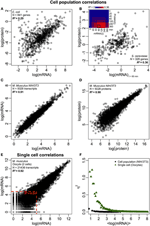
Kuva 2. Omiksia kattavat lausekekorrelaatiot. Solupopulaatiot: mRNA-proteiinikorrelaatiot (A) E. colissa (Taniguchi et ai., 2010) ja (B) S. cerevisiae (Fournier et al., 2010) mRNA-ilmentymien välillä t = 60 min ja proteiini-ilmentymien välillä t = 360 min. Lisää: kaikkien aikapisteiden välinen korrelaatiomatriisi osoittaa viivästyneen korrelaatioiden lisääntymisen mRNA: n ja proteiinien välillä. (C) mRNA- ja (D) proteiiniekspressiot kahden hiiren NIH / 3T3-solunäytteen välillä (Schwanhäusser et ai., 2011). Yksittäiset solut: (E) mRNA-ilmentymät kahden munasolun välillä (Tang et ai., 2009). Punaiset katkoviivat osoittavat matalan mRNA-ilmentymien alueita (log (mRNA) < 5). (F) Melu (η2) versus log (mRNA-ilmentymät) solupopulaatiolle (NIH / 3T3, mustat pisteet, Schwanhäusser et ai., 2011) ja yksittäisille soluille (munasolut, vihreät kolmiot, Tang et ai., 2009). Jokainen piste edustaa P = 100 mRNA: n ryhmän arvoa. η2 on lähellä nollaa solupopulaatiolle kaikille mRNA-ilmentymille. Yksittäisten solujen kohdalla η2 on korkein niiden mRNA: iden kohdalla, joilla on pienin kopioluku, ja lähestyy nollaa suurempien kopiolukujen kohdalla.
Uskomme eroavuuksiin on kaksi suurta syytä. Ensinnäkin, kuten aiemmin todettiin, melu, riippumatta siitä, onko se biologista vai ei-biologista, vähentää korrelaatiota. Koska yksittäisten solujen analyysit ovat osoittaneet stokastisuuden ja vaihtelevuuden tärkeyden, nämä vaikutukset ovat ratkaisevia yksittäisten solujen korrelaatioiden vähentämisessä. Kun solut otetaan näytteistä populaatioon, kokonaismelu (sisäinen + ulkoinen) vähenee, kun satunnainen melu poistuu kaikilta molekyyliekspression alueilta (kuvat 1C – F) keskimääräisen vasteen ja itseorganisaation paljastamiseksi ( Karsenti, 2008; Selvarajoo, 2011; Hekstra ja Leibler, 2012; Selvarajoo ja Giuliani, 2012). Näin ollen syntyy hyvä aste mRNA-proteiinin ilmentämiskorrelaatiota. Toiseksi yksittäissolututkimuksessa (Taniguchi et ai., 2010) verrattiin yksittäisten mRNA-proteiiniekspressiokorrelaatiota lukuisiin soluihin. Solupopulaatiotutkimuksissa vertailu tehdään kuitenkin kokonaisuudessaan tuhansien mRNA: iden ja proteiinien välillä useilla suuruusluokilla suurempi kuin yksittäisen molekyylin solujen välinen ilmentymisalue. Tämä johtaa siis suurempaan korrelaatioon populaatiotasolla, kun yksittäisten molekyylivaihteluiden vaikutus muuttuu merkityksettömäksi.
Huolimatta solupopulaatioiden havaituista korrelaatiorakenteista, täydellisestä korrelaatiosta tapahtuvalle suurelle poikkeamiselle on konkreettisia syitä.Kuten aiemmin todettiin, yksi keskeinen kohta on se, että mRNA: t ja proteiinit sijaitsevat peräkkäin useilla puuttuvilla prosesseilla, joita ei ole edustettu keskeisessä dogmassa. Puuttuvien välituotteiden lisääminen biokemiallisen reitin varrella aiheuttaa huomattavaa viivästystä tietovirrassa (Selvarajoo, 2006, 2011; Piras et al., 2011), ja niiden välinen korrelaatio saattaa kärsiä. Tämä voi olla myös osa tosiasiaa, jonka Taniguchi et ai. että mRNA- ja proteiini-ilmentymillä on erilaiset elinajat. Erityisesti tätä postulaatiota tukee äskettäin tehty Rapamicinilla hoidettu S. cerevisiae -työ, joka osoitti, että mRNA-proteiinin ilmentymisen ajalliset korrelaatiot olivat alun perin alhaiset, R2 = 0,01 40 minuutissa, kuitenkin yli 360 minuuttia häiriön jälkeen, korrelaatio lisääntyi, R2 = 0,36 (Fournier et ai., 2010, kuva 2B). Tiedot osoittavat, että kemiallisessa häiriössä alkuvaste mRNA: n ja proteiiniekspressioiden välillä poikkeaa ajallisen viiveen ja niiden välisten erilaisten kineettisten mekanismien sekä sekundaaristen vaikutusten, kuten autokriinisen tai parakriinisen signaalihäiriön, vuoksi (Shvartsman et al., 2002; Isalan et ai., 2008). Kun häiriön vaikutuksia vaimennetaan ajan myötä, korrelaatiot toipuivat.
Jotta voitaisiin tarkistaa postulaatio, että peräkkäiset viivästysprosessit tai erilaiset elinajat ovat ratkaisevan tärkeitä mRNA-proteiinikorrelaatioiden vähentämisessä, verrattiin R2: ta samoja molekyylilajeja keskeisestä dogmasta (esim. mRNA: n ja mRNA: n välillä) solupopulaatioissa ja yksittäisissä soluissa. NIH / 3T3 (Schwanhäusser et ai., 2011) (kuva 2C) ja Mycobacterium tuberculosis (Ward et ai., 2008) -solujen populaationäytteet ovat transkription laajuisia mRNA-mRNA-ilmentämiskorrelaatioita molemmat erittäin korkeita, R2 id = ”b45f921a3c”> 0,9 (taulukko 1). Tällaisia voimakkaita korrelaatioita havaitaan myös NIH / 3T3-solujen proteiini-proteiini-ilmentymien populaationäytteissä (Schwanhäusser et al., 2011) (kuva 2D), Porphyromonas gingivalis (Xia et ai., 2007) ja Glycine max (Brandão et ai. , 2010) (taulukko 1). Koska nämä samoja lajeja vertaavat tiedot tuottavat erittäin korkeita korrelaatioita, on mahdollista, että peräkkäiset viivästysprosessit tai erilaiset elinajat ovat vastuussa populaatiotason korrelaatiorakenteiden alentamisesta mRNA: n ja proteiini-ilmentymien välillä.
Yksittäisissä hiiren munasoluissa ( Tang et ai., 2009), kun verrataan kokonaisia mRNA – mRNA-ilmentymiä, havaitaan voimakkaasti korreloiva rakenne (R2 = 0,92, kuva 2E). Stokastinen kohina alentaa kuitenkin pareittain korrelaatiota melko dramaattisesti keskittymällä vain vähän ilmaistuihin mRNA: hin (logaritmisilla lausekkeilla < 5) (R2 < 0,54). Tämän tuloksen tutkimiseksi arvioimme melun, η2 = σ2XY / μ2XY, koko mRNA-ilmentymissä (kuvio 2F). Huomasimme, että η2 on korkein matalimmilla lausekkeilla, johtuen stokastisten vaihteluiden voimakkaasta vaikutuksesta niiden ilmentymiin verrattuna, ja lähestyy nollaa korkeammissa ilmentymissä, joissa tällaisen melun merkitys on vähäisempi (Piras et al., 2012). Solupopulaation kohdalla, kuten odotettiin, melkein nolla havaitaan koko ilmentymisalueella satunnaisen melun poistamisen vuoksi (kuviot 1E, F).
Myös koko mRNA – mRNA -ilmentymien korreloivat rakenteet raportoitu yksittäisen syöpäsolun osalta (Fan et ai., 2012), vaikkakin vähemmän merkittävä R2 ~ 0,7 (taulukko 1). Lisäksi proteiini-proteiini-ilmentymien vertailu LPS-stimuloiduissa ihmisen makrofageissa osoitti myös korkeita korrelaatioita, R2 ~ 0,72 (Shin et ai., 2011) (taulukko 1). Vaikka yksittäisten solujen yksittäisten mRNA-proteiiniekspressioiden välillä ei ole korrelaatiota, yksittäisten solujen samojen molekyylilajien välinen laaja-alainen tai omiikkikohtainen korrelaatio on erittäin korkea.
Olipa siis yksittäisiä soluja vai solupopulaatioita , koko omiikkatiedot osoittavat, että korrelaatiot samojen molekyylilajien välillä (mRNA vs. mRNA ja proteiini vs. proteiini) ovat huomattavasti korkeammat kuin eri lajien välillä (mRNA vs. proteiini). Tämä heijastaa sitä tosiasiaa, että vaikka aikaviiveprosessit ja erilaiset elinajat ovat avain korrelaatioiden vähentämisessä, nämä mekanismit eivät riitä tukemaan yksittäisten solujen yksilöllisen transkriptio proteiini-ilmentymien välillä havaitun korrelaatiorakenteen puutetta.
Joten pitkälti tutkimalla mRNA: iden ja eri solujärjestelmien proteiinien laajamittaisia ilmentymiä olemme osoittaneet, että korrelaatiorakenteet syntyvät globaalissa mittakaavassa.Korrelaatioanalyysit kuitenkin paljastavat vain kahden testatun näytteen välisen yhteyden, eivätkä näytä Jotta keskeinen dogma olisi pätevä globaalissa mittakaavassa, tiedon kokonaisvirtauksen tulisi olla DNA: sta proteiineihin. Tällainen tiedonkulku on osoitettu lukemattomilla muilla tutkimuksilla, joihin liittyy solupopulaatioiden reseptorien häiritsemistä ja seuraamista DNA: han sitoutuvien transkriptiotekijöiden dynamiikka ja laajamittaisten geeniekspressioiden indusointi (kuvio 3A).Esimerkiksi LPS-stimuloitujen immuunisolujen tapauksessa on osoitettu, että transkriptiotekijän NF-KB aktivaatio tapahtuu noin 15 minuutissa (Liu et ai., 1999), sen alavirran geenien induktio noin 30 ° C: ssa min (Liu et ai., 1999; Xaus et ai., 2000; Selvarajoo et ai., 2008), ja vastaavien proteiinien translaatio alueella 60–90 min (Kawai et ai., 1999; Xaus et ai. , 2000) (kuva 3B). Tällainen transkription translaatiotiedon virtauksen peräkkäinen suunta havaitaan myös bakteerisysteemeillä, kuten E. coli, solupopulaatiotasolla (Golding ym., 2005).

Kuva 3. Keski-dogman tietovirta. (A) Kaavio LPS / TLR4-indusoidusta TNF-ilmentymästä, transkriptiotekijän NF-KB ja tnf-geenin kautta, lineaarisen informaation virtauksen jälkeen. (B) NF-KB: n (ylemmät paneelit), tnf (keskipaneelit) ja TNF: n (alemmat paneelit) ilmentymien promoottorin sitoutumistoiminnan kokeelliset ajalliset profiilit solupopulaatiotasolla. (C) Promoottorin dynamiikan, mRNA: n ja proteiiniekspressioiden kaaviolliset ajalliset profiilit yksisoluisella tasolla (Raj ja van Oudenaarden, 2009).
Vaihtoehtoisesti yhden solun resoluutiolla tehdyt tutkimukset paljastavat satunnaisia vaihteluita lineaarisessa informaatiovirrassa: DNA-promoottorialueisiin sitoutuvat transkriptiotekijät ovat kvantitatiivisia, mikä johtaa mRNA-transkription räjähtävään käyttäytymiseen ja aiheuttaa myöhemmin vaihtelua proteiinitranslaatiossa jopa identtisten solujen välillä (kuva 3C) (Raj ja van Oudenaarden, 2009; Eldar ja Elowitz, 2010; Locke et ai., 2011; Hekstra ja Leibler, 2012; Selvarajoo, 2012). Tämän seurauksena yksittäisten solujen yksilöllinen molekyylivaste on tietyssä ajankohdassa melko meluisa verrattuna populaation keskiarvoon (Selvarajoo, 2011).
Päätelmät
Esimerkit Tässä artikkelissa korostetaan havaittuja korrelaatioarvojen järjestyksiä keskidogmassa olevien lajien välillä solupopulaatioiden ja yksittäisten solujen välillä. Solupopulaatioiden tilastolliset analyysit kuvaavat kuvan, että ilmentymiskorrelaatio saman molekyylilajin välillä on erittäin korkea ja lajien välillä kohtalaisen korkea. Vaikka yksittäisten solujen korrelaatiot saman lajin välillä ovat vertailukelpoisia solupopulaatioiden kanssa, ne osoittivat laajempaa hajontaa ilmentymäkäyliinsä biologisen melun voimakkaan vaikutuksen vuoksi, etenkin transkripteille, joilla on pieni kopioluku. Erityisesti yksittäisten solujen ”pareittain korrelaatio tulee nollaksi yksittäisille molekyyleille (Taniguchi et ai., 2010). Itse asiassa stokastisten vaihteluiden ja molekyyliekspressioiden vaihtelun tiedetään toimivan solujen kohtalopäätöksen luomisessa ja solutilojen kaatumisessa (Losick ja Desplan, 2008; Eldar ja Elowitz, 2010; Kuwahara ja Schwartz, 2012). Uskomme, että vahvat omiikkien väliset korrelaatiot tapahtuvat tuhansien molekyylien tiukkojen geeni- ja proteiinisäätöverkkojen seurauksena (Barabási ja Oltvai, 2004; Karsenti , 2008), mikä johtaa keskimääräisiin vasteisiin. Analysoimalla pientä määrää tai yksittäisiä molekyylejä korrelaatiorakennetta ei voida havaita.
Kaiken kaikkiaan on mahdollista, että yksittäisen DNA: n ja proteiinin tietovirran tarkastelu kyseenalaistaa keskeisen dogman koska kunkin molekyylin vaste milloin tahansa ei todennäköisesti korreloi, mutta globaalisti keskimääräisen deterministisen vasteen havaitseminen viittaa siihen, että geenin nettotasapaino ic-tiedot pysyvät reittien oikeassa reunassa. Siksi keskeistä dogmaa tulisi pitää makroskooppisena solutietovirtauksena koko omiikan mittakaavassa eikä yksittäisen geenin ja proteiinin välillä. Uskomme, että sen yksinkertaisuus pysyy edelleen yhtenä vaikutusvaltaisimmista elävien järjestelmien teoreettisista pilareista.
Eturistiriita-ilmoitus
Kirjoittajat ilmoittavat, että tutkimus tehtiin sellaisten kaupallisten tai taloudellisten suhteiden puuttuminen, jotka voidaan tulkita mahdollisiksi eturistiriidoiksi.
Kiitokset
Kentaro Hayashia kiitetään kommenteista. Tsuruokan kaupungin ja Yamagatan prefektuurin tutkimusrahastoa arvostetaan heidän tuestaan.
Crick, F. (1958). Proteiinisynteesistä. Symp. Soc. Exp. Biol. 12, 139–163.
Julkaistu tiivistelmä | Julkaistu kokoteksti
Crick, F. (1970). Keskeinen molekyylibiologian dogma. Nature 227, 561–563.
Julkaistu tiivistelmä | Julkaistu kokoteksti
Hayden, E. C. (2011). Todisteet muuttuneesta RNA: sta herättävät keskustelua. Nature 473, 432.
Julkaistu tiivistelmä | Julkaistu kokoteksti | CrossRef-kokoteksti
Hekstra, D.R. ja Leibler, S. (2012). Varautumis- ja tilastolakit mikrobien suljetuissa ekosysteemeissä. Cell 149, 1164–1173.
Julkaistu tiivistelmä | Julkaistu kokoteksti | CrossRef-kokoteksti
Kuwahara, H. ja Schwartz, R. (2012).Stokastinen vakaan tilan voitto geeniekspressioprosessissa, jossa on mRNA: n hajoamisen hallinta. J. R. Soc. Liitäntä 9, 1589–1598.
Julkaistu tiivistelmä | Julkaistu kokoteksti | CrossRef-kokoteksti
Nie, L., Wu, G. ja Zhang, W. (2006). MRNA: n ilmentymisen ja proteiinien runsauden korrelaatio, johon vaikuttaa useita sekvenssiominaisuuksia, jotka liittyvät translaation tehokkuuteen Desulfovibrio vulgarisissa: kvantitatiivinen analyysi. Genetiikka 174, 2229–2243.
Julkaistu tiivistelmä | Julkaistu kokoteksti | CrossRef-kokoteksti
Prusiner, S.B. (1998). Prionit. Proc. Natl. Acad. Sci. U.S.A. 95, 13363–13383.
Julkaistu tiivistelmä | Julkaistu kokoteksti | CrossRef-kokoteksti
Rosner, B. (2011). Biostatistiikan perusteet. 7. edn. Boston, MA: Duxbury Press.
Selvarajoo, K. (2006). Tullin kaltaisen reseptorin 4 signalointireittien differentiaalisen aktivointikoneiston löytäminen MyD88-pudotuksissa. FEBS Lett. 580, 1457–1464.
Julkaistu tiivistelmä | Julkaistu kokoteksti | CrossRef-kokoteksti
Selvarajoo, K. (2011). Makroskooppinen säilyttämislaki paljasti tietullimaisen reseptorisignaloinnin populaatiodynamiikassa. Cell Commun. Signaali. 9, 9.
Julkaistu tiivistelmä | Julkaistu kokoteksti | CrossRef-kokoteksti
Selvarajoo, K. (2012). Multimodaalisten biologisten päätösten ymmärtäminen yhden solun ja populaatiodynamiikan perusteella. Wiley Monitieteinen. Pyhä Syst. Biol. Med. 4, 385–399.
Julkaistu tiivistelmä | Julkaistu kokoteksti | CrossRef-kokoteksti
Stewart, T. R. (1990). Korrelaatiokertoimen hajoaminen ja sen käyttö ennustetaidon analysoinnissa. Sääennuste. 5, 661–666.