La evidencia empírica aclara los factores de riesgo, las causas y las intervenciones de primera línea.
Jeffrey R. Strawn, MD
Clinical instructor en psiquiatría, departamento de psiquiatría, Facultad de medicina de la Universidad de Cincinnati
Paul E. Keck Jr, MD
Profesor de psiquiatría, departamento de psiquiatría, Facultad de medicina de la Universidad de Cincinnati, presidente y director ejecutivo, Lindner Center of HOPE, Cincinnati, OH
Stanley N. Caroff, MD
Profesor de psiquiatría, departamento de psiquiatría, Facultad de medicina de la Universidad de Pensilvania, jefe de psiquiatría para pacientes hospitalizados, servicio de psiquiatría, Filadelfia VA Medical Centro
El diagnóstico y tratamiento del síndrome neuroléptico maligno (SNM) son controvertidos porque este síndrome potencialmente mortal es raro y su presentación varía. Estos factores dificultan la evaluación de tratamientos en ensayos clínicos controlados y los datos sobre la eficacia relativa de intervenciones específicas son escasos. Sin embargo, es posible desarrollar pautas de tratamiento racionales utilizando datos clínicos empíricos.1,2
Este artículo examina la evidencia relacionada con 6 aspectos controvertidos del diagnóstico y tratamiento del SNM:
• factores de riesgo más confiables
• SNM como trastorno del espectro
• qué causa el SNM
• SNM desencadenado por antipsicóticos de primera generación frente a antipsicóticos de segunda generación
• intervenciones de primera línea
• reinicio de los antipsicóticos después de un episodio de SNM.
¿HAY FACTORES DE RIESGO FIABLES PARA EL SNM?
En pequeños estudios de casos y controles, la agitación, la deshidratación y el agotamiento fueron los factores sistémicos más consistentes que se cree que predisponen a los pacientes que toman antipsicóticos al SNM (tabla 1) .3-5 La catatonia y los síndromes cerebrales orgánicos pueden ser factores de riesgo separados.1,6
Los estudios preliminares también han implicado anomalías del receptor de dopamina causadas por polimorfismos genéticos o efectos de niveles bajos de hierro sérico.1,7, 8 Los estudios farmacológicos han sugerido que dosis más altas, titulación rápida y Las inyecciones intramusculares de antipsicóticos se asocian con un mayor riesgo de SNM3,5. Algunos estudios sugieren que entre el 15% y el 20% de los pacientes con SNM tienen antecedentes de episodios de SNM1,2. Además, los antipsicóticos de primera generación de alta potencia (FGA): especialmente haloperidol: se supone que conllevan un riesgo más alto que los fármacos de baja potencia y los antipsicóticos de segunda generación (SGA), aunque esta hipótesis sigue siendo difícil de probar.9-11
Sin embargo, estos factores de riesgo no son prácticos para estimar el riesgo de SNM en un paciente dado porque son relativamente comunes en comparación con el bajo riesgo de aparición de SNM. Para la gran mayoría de los pacientes con síntomas psicóticos, los beneficios de la farmacoterapia antipsicótica correctamente indicada superarán los riesgos.
Tabla 1 ¿Qué aumenta el riesgo de SNM?
- Agitación
- Deshidratación
- Agotamiento
- Concentraciones bajas de hierro en suero (normal: 60 a 170 mcg / dL)
Diagnósticos
- Historia de SNM
- Catatonia
- Síndromes cerebrales orgánicos
Sistema nervioso central
- Disfunción del receptor de dopamina
- Disfunción de los ganglios basales
- Disfunción del sistema nervioso simpático
Tratamiento farmacológico *
- Inyecciones intramusculares o intravenosas
- Antagonistas de la dopamina de alta potencia
- Ajuste rápido de la dosis
- Dosis altas
- FGA en comparación con SGA (?)
* Para pacientes individuales, estos factores de riesgo comunes deben sopesarse nuevamente los beneficios de la terapia antipsicótica
FGA: primero antipsicóticos de segunda generación
PEG: antipsicóticos de segunda generación; SNM: síndrome neuroléptico maligno
Fuente: Referencias 1-5
¿ESTÁ RELACIONADO EL SNM CON PARKINSONISMO, CATATONIA O HIPERTERMIA MALIGNA?
Parkinsonismo. Algunos investigadores han descrito el SNM como una crisis parkinsoniana extrema resultante del bloqueo abrumador de las vías de la dopamina en el cerebro.1,2,12 En este punto de vista, el SNM se asemeja al síndrome de hipertermia parkinsoniana que puede ocurrir en pacientes con enfermedad de Parkinson después de una interrupción abrupta o pérdida de eficacia de la terapia dopaminérgica, que puede tratarse mediante la reinstitución de agentes dopaminérgicos.13 Las pruebas que respaldan este punto de vista incluyen:
• Los signos parkinsonianos son una característica fundamental del SNM.
• La abstinencia de agonistas dopaminérgicos precipita el síndrome.
• Todos los fármacos desencadenantes son antagonistas del receptor de dopamina.
• El riesgo de SNM se correlaciona con la afinidad por el receptor de dopamina de los fármacos.
• Los agonistas dopaminérgicos pueden ser un tratamiento eficaz.
• Las lesiones en las vías dopaminérgicas producen un síndrome similar.
• Los pacientes con SNM han demostrado concentraciones bajas en el líquido cefalorraquídeo del metabolito de la dopamina, ácido homovanílico14. Catatonia. Fink et al15 y otros16-18 han argumentado de manera persuasiva que el SNM representa una forma de catatonia maligna inducida por fármacos. La evidencia que respalda esto incluye:
• Los 2 trastornos comparten síntomas neuropsiquiátricos.
• Los signos catatónicos son comunes en el SNM.19
• La catatonia maligna y el SNM comparten signos fisiológicos y de laboratorio.20
• La reintroducción de antipsicóticos puede empeorar de manera aguda ambas afecciones.
• Benzodiazepinas y terapia electroconvulsiva (TEC) ) son tratamientos eficaces para ambos trastornos.15-18
Lee21 examinó la relación entre las características catatónicas y la respuesta al tratamiento en 14 pacientes con SNM. La mayoría de los pacientes con síntomas catatónicos respondieron a las benzodiazepinas, mientras que ninguno de los que tenían una presentación extrapiramidal-hipertérmica sin catatonia. Lee concluyó que el SNM es heterogéneo y puede presentarse en formas catatónicas y no catatónicas que difieren en la respuesta al tratamiento.
Hipertermia maligna. Algunos médicos han comparado el SNM con la hipertermia maligna causada por anestésicos inhalados y succinilcolina.1,2 La evidencia incluye:
• signos clínicos similares de rigidez, hipertermia e hipermetabolismo
• signos fisiológicos y de laboratorio similares, como rabdomiólisis
• hipertermia en ambos que responden al dantroleno.
Aunque los dos son similares en presentación, la hipertermia maligna ocurre intraoperatoriamente y refleja un trastorno farmacogenético de la regulación del calcio en el músculo esquelético. Además, la rigidez en la hipertermia maligna no responde a los relajantes musculares de acción periférica.1,22 La evidencia sugiere que los pacientes que han experimentado previamente un episodio de SNM no están en riesgo de hipertermia maligna.22
QUÉ ES LA FISIOPATOLOGÍA ¿OF NMS?
La fisiopatología del NMS es compleja y probablemente implica la interacción entre múltiples vías centrales y sistémicas y neurotransmisores. Como se describió anteriormente, la evidencia contundente sugiere que el bloqueo de la dopamina juega un papel central12. Se cree que el bloqueo de la dopamina en el hipotálamo contribuye a la falla termorreguladora y el bloqueo en el sistema nigroestriatal probablemente contribuye a la rigidez muscular y al hipermetabolismo. La pérdida de entrada dopaminérgica al circuito orbitofrontal medial cingulado anterior y al circuito orbitofrontal lateral probablemente contribuye a los cambios del estado mental y las características catatónicas que se observan en el SNM. 12
Sin embargo, algunos investigadores han propuesto hipótesis competitivas o complementarias. Por ejemplo, Gurrera 23 propuso que los pacientes que son propensos a desarrollar NMS tienen una vulnerabilidad a un sistema nervioso simpático hiperactivo y desregulado, y este rasgo, junto con la alteración del sistema de dopamina inducida por agentes bloqueadores de la dopamina, produce NMS. Otros investigadores han implicado a la serotonina, la noradrenalina, el ácido gamma-aminobutírico y los mecanismos glutaminérgicos. 1,12,24,25
¿FGAS O SGAS SON MÁS PROBABLES DE CAUSAR NMS?
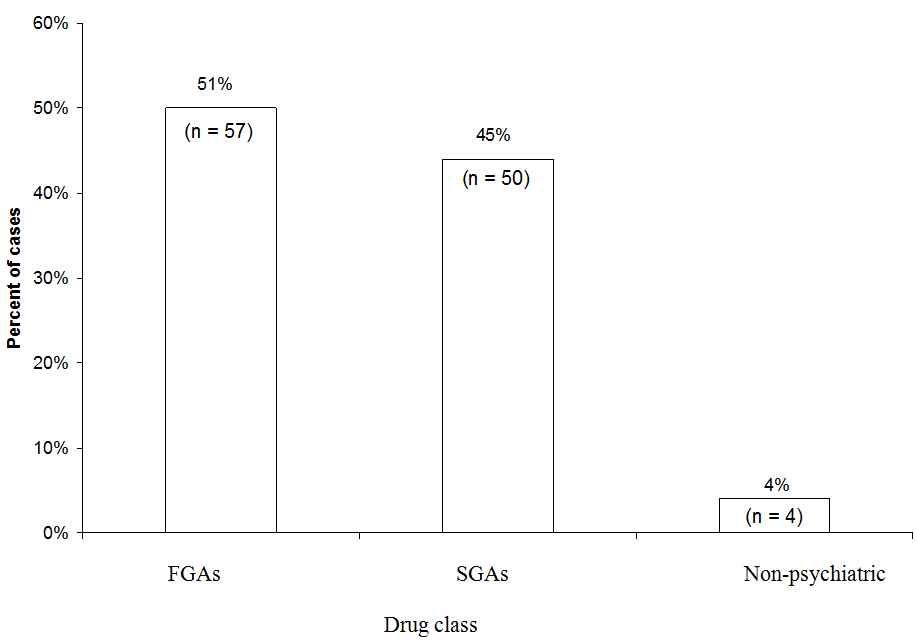
FGA: antipsicótico de primera generación
SGA: antipsicótico de segunda generación
Ligeramente más casos de SNM se atribuyeron a FGA (51%) que a SGA (45%) en un análisis de 111 casos de SNM probable o definitivo asociados con un solo fármaco notificados a la línea directa de NMS entre 1997 y 2006. El haloperidol de FGA representó el 44% de todos los casos. «Médico» se refiere a los casos en los que se utilizó un neuroléptico en un entorno no psiquiátrico.
Fuente: Datos no publicados archivados en el Servicio de Información del Síndrome Neuroléptico Maligno.
Se supone que el SNM ocurre con menos frecuencia en pacientes tratados con PEG que en aquellos que reciben FGA, aunque esta hipótesis no está probada. Se han asociado informes aislados de SNM con casi todos los PEG. Es difícil probar las responsabilidades de FGA frente a SGA porque:
• El SNM es raro.
• Las prácticas de dosificación pueden ser más conservadoras ahora que en el pasado.
• La mayoría de los médicos son conscientes de los primeros signos de SNM.
En un estudio epidemiológico de una gran base de datos, Stubner et al 26 encontraron que los pacientes que recibieron PEG tenían un riesgo menor de SNM que los tratados con haloperidol.26 En este estudio, la tasa global de SNM fue 0.02%.
Datos de la línea directa del NMS. Recientemente, examinamos qué clases de medicamentos estaban implicadas en 111 casos de NMS notificados al Neuroleptic Malignant S Línea directa del Servicio de Información sobre el Síndrome (1-888-NMSTEMP) entre 1997 y 2006 (Figura). Solo incluimos casos de SNM definitivo o probable (diagnosticado por consultores de la línea directa) en los que se administró un único antipsicótico. Un poco más de casos se atribuyeron a FGA (51%) que a SGA (45%). Los casos restantes se atribuyeron a neurolépticos utilizados en entornos médicos (como prometazina o proclorperazina).
Debido a que ahora se recetan con menos frecuencia, los FGA representaron un número desproporcionado de casos de SNM notificados a la línea directa. El haloperidol representó la mayoría de los casos de FGA y el 44% de todos los casos. Si hubiéramos excluido el haloperidol y hubiéramos comparado el riesgo de NMS de los PEG con solo los FGA de potencia intermedia o baja, se habría perdido la ventaja relativa de los PEG. Por otro lado, está claro que los SGA aún conllevan un riesgo para los NMS.
Los análisis sugieren que las características clásicas de NMS asociadas con PEG (fiebre, rigidez muscular y cambios en el estado autonómico y mental) se conservan en pacientes que reciben PEG, aunque algunos pueden no desarrollar la rigidez severa y las temperaturas extremas comunes en pacientes que reciben FGA .9-11 Las características clínicas más leves asociadas con los PEG pueden reflejar patrones de prescripción más conservadores o una mayor conciencia y reconocimiento más temprano del SNM, lo que evitaría presentaciones fulminantes.
¿CUÁL ES LA EVIDENCIA PARA TRATAMIENTOS ESPECÍFICOS DEL SNM?
El SNM es raro, su presentación varía y su progresión es impredecible. Estos factores dificultan la evaluación de tratamientos en ensayos clínicos controlados y los datos sobre la eficacia relativa de intervenciones específicas son escasos.
Aun así, la noción de que el SNM representa una variante extrema del parkinsonismo o catatonia inducida por fármacos sugiere que el SNM específico los tratamientos pueden basarse en la gravedad de los síntomas o en la etapa de presentación. Proponemos una pauta de tratamiento basada en mecanismos teóricos y datos anecdóticos.2,27-29
Soporte. Después de la retirada inmediata de la medicación responsable, la terapia de apoyo es la piedra angular del tratamiento del SNM1,2,27
Para los pacientes que presentan signos y síntomas leves, los cuidados de apoyo y la monitorización clínica cuidadosa pueden ser suficientes. La hipertermia extrema exige resucitación de volumen y medidas de enfriamiento, cuidados médicos intensivos y un control cuidadoso de las complicaciones.
Tratamiento. A pesar de la falta de consenso sobre los tratamientos farmacológicos para el SNM no complicado, aproximadamente el 40% de los pacientes con SNM agudo reciben tratamientos farmacológicos.2
El lorazepam, 1 a 2 mg por vía parenteral, es una terapia de primera línea razonable para el SNM, especialmente en personas con características catatónicas.4,15-18,21,30,31 Algunos investigadores recomiendan dosis más altas.15 Se prefieren las benzodiazepinas si se requiere sedación en pacientes con SNM agitados.4,15-18
Los agentes dopaminérgicos como la bromocriptina y la amantadina mejoran la dopaminérgica transmisión para revertir los síntomas parkinsonianos y se ha informado que reduce el tiempo de recuperación y reduce a la mitad las tasas de mortalidad cuando se usa solo o junto con otros tratamientos.13,27,32,33 La suspensión rápida de estos agentes puede provocar síntomas de rebote, aunque esto puede ser cierto para cualquier tratamiento farmacológico específico del SNM.1,31,32
El dantroleno desacopla el acoplamiento de excitación-contracción al mejorar el secuestro de calcio en el retículo sarcoplásmico en el músculo esquelético y ha sido ed para tratar los síntomas hipermetabólicos del SNM. Algunas revisiones encontraron una mejoría en hasta el 80% de los pacientes con SNM tratados con dantroleno en monoterapia.27,32-35 En comparación con la atención de apoyo, el tiempo de recuperación puede reducirse (y la mortalidad se reduce casi a la mitad) cuando el dantroleno se usa solo o en combinación con otros medicamentos.
No todos los informes de casos han demostrado que el dantroleno, las benzodiazepinas o los agonistas dopaminérgicos son eficaces en el tratamiento del SNM31,36. En nuestra opinión, solo los casos avanzados de SNM, con elevaciones extremas de temperatura, rigidez y evidencia de hipermetabolismo sistémico: beneficio del tratamiento con dantroleno.1,2
La TEC se ha utilizado con éxito para reducir la mortalidad por SNM y otros trastornos del espectro catatónico. Por lo general, se emplea después de que fracasan la terapia de apoyo y las intervenciones psicofarmacológicas.2,15,16,27,37 La TEC para el SNM agudo generalmente consiste en una serie de 6 a 10 tratamientos con colocación de electrodos bilaterales. Inicialmente, es posible que se necesite ECT diaria.15
¿ESTÁN CONTRAINDICADOS LOS ANTIPSICÓTICOS DESPUÉS DE UN EPISODIO DE SNM?
La tasa de recurrencia de SNM en el retratamiento con un antipsicótico ha variado.38 Estimamos que hasta 30 El% de los pacientes pueden tener riesgo de recurrencia del SNM cuando se vuelven a tratar con un antipsicótico.1 Sin embargo, si sigue las precauciones adecuadas (Tabla 2), puede tratar de manera segura a la mayoría de los pacientes que requieren terapia antipsicótica continua.1,2
Cuando reinicie el tratamiento , un antipsicótico de menor potencia de una clase química diferente puede ser una opción más segura que volver a probar el agente desencadenante, según análisis retrospectivos de datos limitados disponibles. Un paciente que desarrolla SNM en un FGA podría beneficiarse de un ensayo SGA, aunque persiste cierto riesgo de recurrencia.1,10
Tabla 2 Reintroducción de antipsicóticos después de un episodio de SNM
Vuelva a comprobar la precisión del diagnóstico de un episodio de SNM anterior
Documentar las indicaciones para medicamentos antipsicóticos
Discuta los riesgos y beneficios, incluido el riesgo de recurrencia, con el paciente y la familia
Considere agentes farmacológicos alternativos
Minimice los factores de riesgo (Tabla 1)
Deje transcurrir ≥2 semanas (≥4 semanas para los medicamentos inyectables de acción prolongada) después de que se resuelva un episodio de SNM antes de volver a administrar el tratamiento
Seleccione FGA o SGA de baja potencia
Prescriba una dosis de prueba inicial
Controle los signos vitales y el estado neurológico
Valorar dosis gradualmente
FGA: antipsicóticos de primera generación;
SGA: antipsicóticos de segunda generación
Fuente: Referencias 1,2
Recursos relacionados
• Servicio de información sobre el síndrome neuroléptico maligno. www.nmsis.org.
• Zarrouf FA, Bhanot V. Síndrome neuroléptico maligno: no bajes la guardia todavía. Current Psychiatry 2007; 6 (8): 89-95.
Nombres de marca de medicamentos
Amantadina • Symmetrel
Bromocriptina • Parlodel
Clorpromazina • Thorazina
Dantroleno • Dantrium®
Flufenazina • Prolixina
Haloperidol • Haldol
Lorazepam • Ativan
Loxapina • Loxitano
Perfenazina • Trilafón
Proclorperazina • Compazina, Compro
Prometazina • Phenergan
Tioridazina • Mellaril
Divulgación
Dr. Strawn es un Instituto Estadounidense de Psiquiatría para la Investigación y la Educación (APIRE) / Janssen Scholar.
Dr. Keck ha recibido apoyo de investigación o se ha desempeñado como consultor de Abbott Laboratories, American Diabetes Association, AstraZeneca Pharmaceuticals, Bristol-Myers Squibb, GlaxoSmithKline, Eli Lilly and Company, Janssen Pharmaceutica, National Institute of Mental Health, National Institute of Drug Abuse, Pfizer , Stanley Medical Research Institute y UCB Pharma.
Dr. Caroff ha recibido apoyo para la investigación de Bristol-Myers Squibb, Ortho-McNeil Neurologics y Pfizer.
- Caroff SN. Síndrome neuroléptico maligno. En: Mann SC, Caroff SN, Keck PE Jr, Lazarus A, eds. Síndrome neuroléptico maligno y afecciones relacionadas 2da ed. Washington, DC: American Psychiatric Publishing Inc; 2003; 1-44.
- Strawn JR, Keck PE Jr, Caroff SN. Síndrome neuroléptico maligno Am J Psychiatry 2007; 164: 870–6.
- Keck PE Jr, Pope HG Jr, Cohen BM, et al. Factores de riesgo del síndrome neuroléptico maligno Arch Gen Psychiatry 1989; 46: 914–18.
- Rosebush PI, Stewart TD. Un análisis prospectivo de 24 episodios de síndrome neuroléptico maligno Am J Psychiatry 1989; 146: 717-25.
- Berardi D, Amore M, Keck PE Jr, et al. Factores de riesgo clínicos y farmacológicos para el síndrome neuroléptico maligno: un estudio de casos y controles. Biol Psychiatry 1998; 44: 748–54.
- White DA, Robins AH. Catatonia: presagio del síndrome neuroléptico maligno Br J Psychiatry 1991; 158: 419–21.
- Rosebush PI, Mazurek MF. Hierro sérico y síndrome neuroléptico maligno. Lancet 1991; 338: 149–51.
- Lee JW. Hierro sérico en la catatonia y el síndrome neuroléptico maligno Biol Psychiatry 1998; 44: 499–507.
- Ananth J, Parameswaran S, Gunatilake S, et al. Síndrome neuroléptico maligno y fármacos antipsicóticos atípicos J Clin Psychiatry 2004; 65: 464–70.
- Caroff SN, Mann SC, Campbell EC. Antipsicóticos atípicos y síndrome neuroléptico maligno Psychiatr Ann 2000; 30: 314-21.
- Hasan S, Buckley P. Nuevos antipsicóticos y el síndrome neuroléptico maligno Am J Psychiatry 1998; 155: 1113-16.
- Mann SC, Caroff SN, Fricchione G, Campbell EC. Hipoactividad central de la dopamina y patogenia del síndrome neuroléptico maligno Psychiatr Ann 2000; 30: 363-74.
- Factor SA, Santiago A. Síndrome de parkinsonismo-hiperpirexia en la enfermedad de Parkinson. En: Frucht SJ, Fahn S, eds . Emergencias por trastornos del movimiento: diagnóstico y tratamiento. Totowa, Nueva Jersey: Humana Press; 2005; 29-40.
- Nisijima K, Ishiguro T. Niveles en el líquido cefalorraquídeo de metabolitos de monoamina y ácido gamma-aminobutírico en el síndrome neuroléptico maligno. J Psychiatr Res 1995; 27: 233–44.
- Fink M, Taylor MA. El síndrome neuroléptico maligno es la catatonia maligna, lo que justifica tratamientos eficaces para la catatonia. Prog Neuropsychopharmacol Biol Psychiatry 2006; 30: 1182–3.
- Fricchione G, Bush G, Fozdar M, et al. Reconocimiento y tratamiento del síndrome catatónico. J Intensive Care Med 1997; 12: 135–47.
- Philbrick KL, Rummans TA. Catatonia maligna. J Neuropsychiatry Clin Neurosci 1994; 6: 1–13.
- Mann SC, Caroff SN, Bleier HR, et al. Catatonia letal. Am J Psychiatry 1986; 143: 1374–81.
- Koch M, Chandragiri S, Rizvi S, et al. Signos catatónicos en el síndrome neuroléptico maligno. Compr Psychiatry 2000; 41: 73–5.
- Lee JW. Descubrimientos de laboratorio. En: Caroff SN, Mann SC, Francis A, Fricchoine GL, eds. Catatonia: de la psicopatología a la neurobiología Washington, DC: American Psychiatric Press, Inc; 2004; 65-75.
- Lee JW.Variantes catatónicas, reacciones extrapiramidales hipertérmicas y subtipos de síndrome neuroléptico maligno. Ann Clin Psychiatry 2007; 19: 9–16.
- Caroff SN, Rosenberg H, Mann SC, et al. Síndrome neuroléptico maligno en el entorno perioperatorio. Am J Anesthesiol 2001; 28: 387–93.
- Gurrera RJ. Hiperactividad simpatoadrenal y etiología del síndrome neuroléptico maligno. Am J Psychiatry 1999; 156: 169–80.
- Carroll BT. La hipótesis del campo universal de la catatonia y el síndrome neuroléptico maligno. CNS Spectr 2000; 5: 26–33.
- Weller M, Kornhuber J. Justificación de la terapia con antagonistas del receptor NMDA del síndrome neuroléptico maligno. Med Hypotheses 1992; 38: 329–33.
- Stubner S, Rustenbeck E, Grohmann R, et al. Trastornos del movimiento involuntario graves y poco frecuentes debidos a fármacos psicotrópicos. Farmacopsiquiatría 2004; 37 (supl. 1): S54 – S64.
- Davis JM, Caroff SN, Mann SC. Tratamiento del síndrome neuroléptico maligno. Psychiatr Ann 2000; 30: 325–31.
- Adityanjee PA, Singh S, Singh G, Ong S. Concepto de espectro del síndrome neuroléptico maligno. Br J Psychiatry 1988; 153: 107-11.
- Woodbury MM, Woodbury MA. Catatonia inducida por neurolépticos como una etapa en la progresión hacia el síndrome neuroléptico maligno. J Am Acad Child Adolesc Psychiatry 1992; 31: 1161–4.
- Francis A, Chondragivi S, Rizvi S, et al. ¿Es el lorazepam un tratamiento para el síndrome neuroléptico maligno? CNS Spectr 2000; 5: 54–7.
- Rosebush PI, Stewart T, Mazurek MF. El tratamiento del síndrome neuroléptico maligno. ¿Son el dantroleno y la bromocriptina complementos útiles de la atención de apoyo? Br J Psychiatry 1991; 159: 709-12.
- Sakkas P, Davis JM, Janicak PG, Wang ZY. Tratamiento farmacológico del síndrome neuroléptico maligno. Psychopharmacol Bull 1991; 27: 381–4.
- Rosenberg MR, Green M. Síndrome neuroléptico maligno: revisión de la respuesta a la terapia. Arch Intern Med 1989; 149: 1927–31.
- Yamawaki S, Morio M, Kazamutsuri G, et al. Evaluación clínica y uso eficaz de dantroleno sódico en el síndrome neuroléptico maligno. Kiso a Rinsyou (informes clínicos) 1993; 27: 1045–66.
- Tsutsumi Y, Yamamoto K, Matsuura S, et al. El tratamiento del síndrome neuroléptico maligno con dantroleno sódico. Psychiatry Clin Neurosci 1998; 52: 433–8.
- Reulbach U, Dutsch C, Biermann T, et al. Gestionar un tratamiento eficaz para el síndrome neuroléptico maligno. Crit Care 2007; 11: R4.
- Troller JN, Sachdev PS. Tratamiento electroconvulsivo del síndrome neuroléptico maligno: revisión y reporte de casos. Aust N Z J Psychiatry 1999; 33: 650–9.
- Pope HG, Aizley HG, Keck PE Jr, McElroy SL. Síndrome neuroléptico maligno: seguimiento a largo plazo de 20 casos. J Clin Psychiatry 1991; 52: 208–12.