Introducción
Bostezar es una secuencia involuntaria de apertura de la boca, inspiración profunda, apnea breve y espiración más o menos lenta (Baenninger, 1997; Walusinski y Diputado, 2004; Guggisberg et al., 2010; Krestel et al., 2018). Cuando se provoca, un bostezo no se puede suprimir por completo. Por lo tanto, se ha definido como un patrón estereotipado o reflejo (Lehmann, 1979; Provine, 1986). En Homo sapiens se han planteado varias hipótesis con soporte variable para explicar los mecanismos y funciones del bostezo espontáneo, como la oxigenación (función respiratoria provocada por hipoxia), la conducta relacionada con el estrés (provocada por la excitación) o la termorregulación (provocada por la hipertermia); Guggisberg et al., 2010; Massen et al., 2014; Gallup y Gallup, 2019). Al ser una respuesta fisiológica, el bostezo puede verse afectado por factores internos y externos como la hora del día (Giganti y Zilli, 2011) o la temperatura intracraneal / cerebral (Gallup y Eldakar, 2013).
El bostezo puede ser autodirigido y / o mostrarse a los demás (Moyaho et al., 2017; Palagi et al., 2019). En primates humanos y no humanos, dependiendo de la especie, cuando el bostezo se muestra a otros, puede comunicar una amenaza (Troisi et al., 1990; Deputte, 1994) y / o cambios fisiológicos y de comportamiento (Provine et al., 1987 ; Leone et al., 2015; Zannella et al., 2015). En los seres humanos, el bostezo es una respuesta socialmente modulada porque puede ser inhibido por la presencia social real (y no virtual) (Gallup et al., 2019) y porque un bostezo puede ser provocado por el bostezo de otra persona, como resultado de un fenómeno conocido como bostezos contagiosos (Provine, 1989, 2005). El contagio del bostezo se puede provocar incluso si el bostezo se escucha pero no se ve (Arnott et al., 2009; Massen et al., 2015).
En los humanos, su especie de simios filogenéticamente más cercana (chimpancés: Pan paniscus ; bonobos: Pan troglodytes) y el mono africano Theropithecus gelada, el bostezo contagioso no solo está presente (Provine, 1986; Palagi et al., 2009; Tan et al., 2017; pero ver: Amici et al., 2014) sino también modulado socialmente porque la respuesta de bostezo es más alta cuando ciertas categorías de individuos están involucrados (por ejemplo, parientes, miembros del grupo, dominantes; Palagi et al., 2009; Campbell y de Waal, 2011, 2014; Norscia y Palagi, 2011; Demuru y Palagi, 2012; Massen et al., 2012). Para explicar esta asimetría social en el bostezo contagioso se han presentado dos argumentos principales, que se han agrupado en dos hipótesis principales: la Hipótesis del sesgo emocional (EBH), que vincula el bostezo contagioso con la transferencia emocional, y la Hipótesis del sesgo atencional (ABH), que considera bostezo contagioso como una respuesta motora que está sujeta a diferencias en los procesos de atención de arriba hacia abajo (Palagi et al., 2020).
La EBH predice que la asimetría social observada en las tasas de contagio del bostezo refleja diferencias en los diferentes la vinculación social, una representación de la vinculación emocional, entre individuos. Esta hipótesis está respaldada por la evidencia de que las tasas de contagio del bostezo siguen una tendencia empática (sensu Preston y de Waal, 2002), siendo más alta entre individuos que comparten un vínculo emocional más fuerte. Específicamente, Norscia y Palagi (2011) encontraron que en los humanos las tasas de contagio del bostezo son mayores en respuesta a parientes y amigos que en respuesta a conocidos y extraños. En los chimpancés adultos, el contagio del bostezo es mayor entre los miembros del grupo en comparación con los miembros del grupo externo (Campbell y de Waal, 2011) y en los bonobos, las tasas de contagio del bostezo son mayores entre los individuos que se afilian más entre sí (Demuru y Palagi, 2012). En una investigación comparativa que incluyó tanto a humanos como a bonobos, Palagi et al. (2014) encontraron que las tasas de contagio del bostezo se vieron afectadas por la calidad de la relación entre los individuos más que por la especie a la que pertenecían los sujetos. Además, en los humanos, el contagio del bostezo aumenta con la edad cuando la capacidad de identificar las emociones de los demás aumenta y disminuye con la vejez cuando dicha capacidad disminuye (Wiggers y van Lieshout, 1985; Anderson y Meno, 2003; Saxe et al., 2004; Singer, 2006; Millen y Anderson, 2011; Bartholomew y Cirulli, 2014). Las tasas de contagio del bostezo aumentan desde la infancia hasta la edad adulta también en chimpancés (Madsen y Persson, 2013).
La ABH predice que la asimetría social observada en el contagio del bostezo puede deberse a diferencias en la atención social y visual (Massen y Gallup, 2017). En particular, los niveles más altos de bostezos contagiosos se deben a la atención visual selectiva y de arriba hacia abajo adicional que se presta a los individuos que son más relevantes para el observador, como los sujetos familiares, como ocurre en los humanos y las geladas, o dominantes, ya que ocurre en chimpancés o bonobos (Yoon y Tennie, 2010; Massen et al., 2012; Massen y Gallup, 2017).Según Massen y Gallup (2017), ABH estaría respaldado por la evidencia existente sobre la diferente detección visual y codificación visual perceptiva de rostros de sujetos familiares y / o dentro del grupo en comparación con los desconocidos (p. Ej., Buttle y Raymond, 2003 ; Ganel y Goshen-Gottstein, 2004; Jackson y Raymond, 2006; Michel et al., 2006).
En este estudio, analizamos datos sobre bostezos recopilados durante 9 años en humanos en su entorno natural y extrapolamos los casos en los que el bostezo emitido por un sujeto podía ser escuchado pero no visto por un respondedor potencial (bostezo auditivo). Al considerar solo los casos en los que la señal visual del estímulo del bostezo no fue detectable, verificamos si la asimetría social observada previamente en las tasas de contagio del bostezo persistía o no. En particular, probamos las siguientes predicciones alternativas derivadas de las dos hipótesis presentadas anteriormente (EBH y ABH).
Predicción 1a: según la EBH, las tasas de contagio del bostezo están influenciadas por la fuerza del inter -vínculo social individual — un sustituto del vínculo emocional — per se y no por una atención visual selectiva de arriba hacia abajo diferente que se presta a ciertos individuos en particular. Si se apoya esta hipótesis, esperamos observar el sesgo social también cuando se excluye la señal visual del estímulo de bostezo y las tasas de bostezos contagiosos auditivos sean más altas entre individuos fuertemente vinculados en comparación con individuos débilmente vinculados.
Predicción 1b: según la ABH, los niveles más altos de contagio de bostezos entre individuos fuertemente vinculados en comparación con individuos débilmente vinculados estarían vinculados a la atención visual selectiva, de arriba hacia abajo más cercana, que los individuos prestan a individuos que son relevantes para ellos, por ejemplo, la familia y amigos. Si se apoya esta hipótesis, el sesgo social observado en el contagio del bostezo debería desaparecer cuando solo se consideran los bostezos auditivos porque el posible respondedor no puede atender la señal visual.
Materiales y métodos
Recolección de datos y definiciones operativas
Para este estudio, consideramos los bostezos vocalizados emitidos por un sujeto que solo podía ser escuchado, pero no visto, por un respondedor potencial (en adelante: bostezos auditivos). El emisor y los potenciales respondedores tenían que estar en un rango de ≤5 m. Los bostezos vocalizados implicaban el uso de cuerdas vocales y los bostezos que sólo implicaban inspiración / espiración intensa no se consideraban vocalizados; Se extrapolaron 294 casos de bostezos auditivos de un conjunto de datos de un total de 2001 episodios de bostezos recopilados durante 9 años, de 2010 a 2019, utilizando el método de muestreo de todas las ocurrencias (Altmann, 1974). Específicamente, se recogieron bostezos auditivos desde noviembre de 2010 hasta mayo de 2019, de 05.30 a 02.30 horas, en sujetos humanos caucásicos, de 18 a 77 años, durante sus actividades rutinarias, por ejemplo, en lugares de trabajo, durante las comidas, durante reuniones sociales, etc. ., con los sujetos inconscientes de ser observados y en ausencia de cualquier fuente externa evidente de ansiedad. La base de datos de bostezos auditivos incluía 193 díadas de respuesta potencial de bostezos. Dependiendo de la situación, la información se registraba, sin anotar, mediante códigos alfanuméricos y se ingresaba directamente en hojas de cálculo, se mecanografiaba en teléfonos móviles o se escribía en papel, y luego se ingresaba en hojas de cálculo para su posterior elaboración. Los autores conocían información básica como la edad y la relación entre las personas. Los posibles respondedores se codificaron como en la condición de no visión cuando su cabeza se giraba 180 ° con respecto al gatillo o cuando estaba presente un obstáculo físico que bloqueaba la vista que impedía que el posible respondedor viera la cara y el cuerpo del gatillo. El gatillo y el respondedor nunca estuvieron completamente aislados (por ejemplo, en dos habitaciones separadas con puertas cerradas) entre sí. La cercanía social se recogió en cuatro niveles: 0 = extraños, que nunca se habían conocido antes; 1 = conocidos, que compartieron exclusivamente una relación indirecta basada en un tercer elemento externo, que es el deber laboral (compañeros) o amigos en común (amigos de amigos); 2 = amigos, individuos no emparentados que comparten una relación directa no relacionada exclusivamente con un tercer elemento externo; 3 = parejas y familiares habituales (r ≥ 0,25). La literatura anterior informa que las respuestas de bostezo pueden obtenerse dentro de los 5 minutos posteriores a ver el bostezo de otra persona (el bostezo desencadenante) (Provine, 1986), con un máximo en el primer minuto (Provine, 2005; Palagi et al., 2014). La literatura también informa que a partir del cuarto minuto existe una mayor probabilidad de autocorrelación (lo que significa que la presencia de un bostezo realizado por un sujeto en t0 aumenta la probabilidad de que el mismo sujeto vuelva a bostezar en t (0 + X) donde X es la unidad de tiempo creciente; Kapitány y Nielsen, 2017). Por lo tanto, consideramos las respuestas de bostezo que ocurren dentro de una ventana de tiempo de 3 minutos desde el bostezo emitido por el disparador.Para reducir aún más el sesgo de autocorrelación, en caso de una cadena de bostezos emitidos por el gatillo (más bostezos emitidos en la ventana de tiempo de 3 minutos) registramos como respuesta solo el primer bostezo realizado después de la percepción del último bostezo. Codificamos un bostezo como «espontáneo» cuando ningún otro sujeto había bostezado en los 5 minutos anteriores al evento de bostezo.
Análisis estadísticos
Para los análisis, se consideraron las siguientes variables: ocurrencia de contagio, codificado como: 1 = presencia, 0 = ausencia; el vínculo social se ingresó con los cuatro niveles definidos anteriormente (0 = extraños; 1 = conocidos; 2 = amigos; 3 = parientes); el desencadenante y el sexo del observador se etiquetaron como : M = hombre, F = mujer; las clases de edad del desencadenante y el respondedor se codificaron de la siguiente manera: yo = joven (18-24 años); ad = adulto (25-64 años); se = senior (arriba 65 años) (Statistics Canada, 2009); las franjas horarias se codificaron de la siguiente manera: 1 = 05: 30–09: 00 am; 2 = 09:01 am – 12: 30 pm; 3 = 12: 31–16: 00 pm; 4 = 16: 01–19: 30 pm; 5 = 19: 31–23: 00 pm; 6 = 23: 01–02: 30 (Giganti y Zilli, 2011). La base de datos (consulte la hoja de datos complementaria) incluyó 84 hombres, 69 mujeres, 16 jóvenes (yo), 122 adultos (ad) y 15 adultos mayores (se). Para probar si la aparición de bostezos el contagio fue influenciado por los factores vínculo (0 = extraños; 1 = conocidos; 2 = amigos; 3 = kin), sexo del desencadenante (Trigger_sex), sexo del respondedor (Responder_sex), la clase de edad del desencadenante (Trigger_ageclass) y la clase de edad del respondedor (Responder_ageclass) y el intervalo de tiempo (de 1 a 6 ), utilizamos un modelo mixto lineal generalizado (GLMM) que incluía estos cinco predictores como efectos fijos y desencadenantes (Trigger) y las identidades de respondedores (Respondedor) como efectos aleatorios. Ajustamos los modelos en R (R Core Team, 2018; versión 3.5.1) usando la función lmer del paquete R lme4 (Bates et al., 2015). Establecimos la significancia del modelo completo comparándolo con un modelo nulo que comprende únicamente los efectos aleatorios (Forstmeier y Schielzeth, 2011). Usamos una prueba de razón de verosimilitud (Dobson, 2002) para probar esta significancia (ANOVA con argumento «Chisq»). Calculamos los valores p para los predictores individuales basados en pruebas de razón de verosimilitud entre el modelo completo y el nulo usando la R -función «drop1» (Barr et al., 2013). Como la variable de respuesta era binaria, utilizamos una distribución de error binomial. Probamos si la interacción entre los sexos o las clases de edad del desencadenante y el respondedor eran significativas, pero como no lo eran, no los incluimos en el modelo. Usamos un paquete de contraste múltiple (multcomp) para realizar todas las comparaciones por pares para cada nivel de unión con la prueba de Tukey (Bretz et al., 2010). Informamos los valores p ajustados por Bonferroni, la estimación (Est), el error estándar (SE) y los valores z.
Resultados

Figura 1. Gráfico de línea del efecto del vínculo social entre el desencadenante y el respondedor (eje X) sobre la ocurrencia media del contagio del bostezo acústico (eje Y). Los amigos y parientes muestran frecuencias de contagio de bostezos significativamente más altas que los extraños y conocidos (prueba de Tukey: amigos frente a extraños p < 0,001; parientes frente a extraños p < 0.001; amigos versus conocidos p < 0.001; parientes versus conocidos p < 0.001; otras combinaciones, ns).
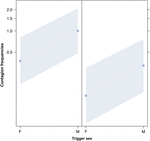
Figura 2. Gráfico de línea de el efecto del sexo del disparador (eje X) sobre la ocurrencia media del contagio acústico del bostezo (eje Y). Efecto del sexo desencadenante sobre el contagio acústico del bostezo cuando el respondedor es una mujer (derecha) y un hombre (izquierda). Los bostezos de los machos provocan más bostezos que los de las hembras independientemente del sexo del respondedor (resultado del GLMM, p = 0,022). Los puntos representan el efecto que tiene la variable de respuesta sobre la variable independiente «sexo del disparador», según el valor predicho por el modelo. Las bandas de colores muestran el intervalo de confianza del 95%.
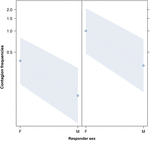
Figura 3. Diagrama de línea del efecto del sexo del respuesta (eje X) en la ocurrencia media del contagio acústico del bostezo (eje Y). Efecto del sexo del respondedor sobre el contagio acústico del bostezo cuando el desencadenante es una mujer (derecha) o un hombre (izquierda). Las mujeres responden significativamente más que los hombres independientemente del sexo del desencadenante (resultado del GLMM, p = 0.021) Los puntos representan el efecto que la variable de respuesta tiene sobre la variable independiente «sexo del respondedor», según el valor predicho por el modelo. Las bandas de colores muestran el intervalo de confianza del 95%.
Discusión
Este estudio muestra por primera vez que el contagio del bostezo se ve afectado significativamente por el vínculo social entre individuos (Tabla 1) incluso cuando los estímulos desencadenantes son bostezos auditivos, que definimos como bostezos vocalizados que se podían escuchar pero no ver (señal visual indetectable, señal auditiva detectable). En particular, el bostezo auditivo contagioso es significativamente más frecuente entre familiares y amigos que entre extraños y conocidos (Figura 1). Este hallazgo apoya la predicción 1a basada en la EBH y no la predicción 1b basada en la ABH, lo que lleva a la conclusión de que en los humanos, la atención visual selectiva de arriba hacia abajo no puede ser el principal impulsor de la asimetría social observada en las tasas de contagio del bostezo (Norscia y Palagi , 2011; Norscia et al., 2016a). Además, el sexo del desencadenante y el sexo del receptor tuvieron un efecto significativo en las tasas de contagio del bostezo, ya que los hombres, como desencadenantes, fueron respondidos por otros con más frecuencia que las mujeres (Figura 2) y las mujeres respondieron con más frecuencia a los bostezos de otros que hombres (Figura 3).
A diferencia de Bartholomew y Cirulli (2014), no encontramos ningún efecto de la edad en el contagio del bostezo, muy probablemente porque nuestra base de datos sobre bostezos auditivos tenía una fuerte prevalencia de adultos (25-64 años viejo). Los niveles más altos de contagio auditivo del bostezo en mujeres en comparación con los hombres confirman el sesgo de género observado en condiciones naturalistas en humanos susceptibles al contagio por bostezo por Norscia et al. (2016a, b) al considerar un conjunto de datos más grande que también incluía bostezos que podrían ser vistos por el respondedor potencial (con la modalidad sensorial de bostezos, visión, audición o ambas, sin afectar la respuesta). El sesgo de género también está en concordancia parcial con los resultados anteriores obtenidos en entornos controlados, incluida la señal visual (Chan y Tseng, 2017; pero ver Norscia y Palagi, 2011; Bartholomew y Cirulli, 2014). Se ha planteado la hipótesis de que el alto grado de contagio del bostezo en las mujeres podría informar el contagio emocional (Norscia et al., 2016a), a la luz de las capacidades empáticas supuestamente más altas, relacionadas con la maternidad, de las mujeres en comparación con los hombres (Christov-Moore et al. ., 2014). Sin embargo, este tema aún está en debate porque las diferencias culturales entre las sociedades humanas pueden moldear la dinámica de los vínculos sociales de una manera diferente. Por tanto, es complicado, en esta etapa del conocimiento, desenredar los factores culturales, la calidad de la relación interpersonal y la influencia del género en la distribución del contagio del bostezo. Nuestros resultados también muestran que los hombres se desempeñan mejor que las mujeres como desencadenantes y la hipótesis más parsimoniosa para esto podría ser que las vocalizaciones de los hombres se pueden escuchar mejor en entornos naturales, a menudo caracterizados por ruidos de fondo. De hecho, la percepción del género de la voz se basa principalmente en la frecuencia fundamental que, en promedio, es una octava más baja en las voces masculinas que en las femeninas, y las vocalizaciones de baja frecuencia viajan más lejos que las de alta frecuencia (Marten y Marler, 1977; Latinus y Taylor, 2012). . Sin embargo, hasta donde sabemos, no existe un estudio específico que aborde el posible sesgo de género en la audibilidad del bostezo y, por lo tanto, es necesario realizar más investigaciones con ensayos experimentales en condiciones controladas para verificar esta especulación.
En este estudio, también encontramos que las diferencias en las tasas de contagio del bostezo entre categorías (familiares y amigos, extraños y conocidos) no pueden explicarse por las diferencias en la atención visual selectiva de arriba hacia abajo. Este hallazgo está en línea con la literatura previa. El bostezo contagioso parece involucrar áreas del cerebro que están más relacionadas con la red de orientación de abajo hacia arriba que las áreas relacionadas de arriba hacia abajo. Además, el contagio del bostezo no es sensible a las señales sensoriales presentes en la señal (auditiva, visual o audiovisual) (Arnott et al., 2009; Norscia y Palagi, 2011) ni se ve afectado por la perspectiva visual del estímulo desencadenante ( Los bostezos en orientaciones de 90 °, 180 ° y 270 ° pueden desencadenar respuestas de bostezo como bostezos frontales de 0 °; Provine, 1989, 1996). Chan y Tseng (2017) encontraron que la capacidad de detectar un bostezo como tal (sensibilidad de detección perceptiva) estaba relacionada con la duración de la mirada a los ojos del rostro que libera el estímulo, pero los patrones de la mirada no pueden modular el bostezo contagioso. En los chimpancés, las frecuencias de bostezos contagiosos fueron más altas entre individuos del mismo grupo que entre individuos de diferentes grupos, incluso si los que respondieron miraron por más tiempo los videos de chimpancés fuera del grupo (Campbell y de Waal, 2011). El argumento de que la atención selectiva visual puede sesgar las tasas de contagio del bostezo en una dirección específica (los sujetos responden más a la familia que a los extraños) también se ve socavado por la ausencia de un patrón específico de atención social en primates humanos y no humanos. Mediante seguimiento ocular (aplicado para medir el tiempo de visualización) y mostrando rostros desconocidos a sus sujetos experimentales, Méary et al.(2014) observaron que los humanos se inclinaban hacia rostros de su propia raza, mientras que la atención de los macacos rhesus era más atraída por rostros nuevos que por rostros de la misma especie. Kawakami y col. (2014) observaron que los sujetos humanos prestaban más atención a los ojos de los miembros del grupo étnico y a la nariz y la boca de los miembros del grupo étnico. El mismo estudio también reveló que la atención visual no dependía de la raza objetivo. Al medir cuánto tiempo los sujetos experimentales miraron la pantalla, Whitehouse et al. (2016) observaron que los macacos de Berbería prestaron más atención a los videos de raspaduras de individuos no extraños que a individuos extraños, pero también observaron que dentro de los no extraños, los macacos prestaron más atención a aquellos individuos con los que compartían un vínculo social débil. Al medir las tasas de mirada, Schino y Sciarretta (2016) observaron que los mandriles miraban más a sus propios parientes que a los no parientes, pero también más a los compañeros de grupo dominantes que a los subordinados. Por lo tanto, estos estudios (utilizados para respaldar la ABH) no describen un patrón único de atención selectiva. Otro punto importante a considerar es la definición misma de familiaridad y membresía grupal adoptada por la mayoría de los estudios utilizados para respaldar ABH (Massen y Gallup, 2017). Estos estudios mostraron una mejor detección visual y codificación visual perceptiva de rostros de sujetos familiares / en grupo en comparación con los desconocidos, pero definieron la familiaridad y la pertenencia al grupo no sobre la base de las relaciones personales entre individuos. En cambio, la familiaridad o la pertenencia a un grupo se definieron sobre la base del conocimiento indirecto (por ejemplo, foto de personas famosas o de un tema que ya se mostró en las fases previas al juicio) o raza común (por ejemplo, Buttle y Raymond, 2003; Ganel y Goshen- Gottstein, 2004; Jackson y Raymond, 2006; Michel et al., 2006). Esta definición está bien para los propósitos de estos estudios, pero no tanto si los resultados se utilizan para proponer explicaciones alternativas de la influencia que el vínculo social real, basado en relaciones reales, puede tener sobre un fenómeno, en este caso el contagio del bostezo. . Por ejemplo, Michel et al. (2006) observaron que los sujetos caucásicos y asiáticos podían reconocer mejor las caras de la misma raza, pero esta diferencia no estaba presente en los sujetos asiáticos que habían estado viviendo durante aproximadamente un año entre los caucásicos. Otro punto de discusión se refiere a la presencia de contagio del bostezo en niños con trastorno del espectro autista (TEA), que con frecuencia muestran alteraciones en la atención visual (Richard y Lajiness-O’Neill, 2015). En los niños con TEA, el contagio del bostezo puede estar ausente (Senju et al., 2007), deteriorado (Helt et al., 2010) o similar a los niños con desarrollo típico cuando se induce a los sujetos a redirigir su atención al estímulo de video durante los ensayos experimentales (Usui et al., 2013). En un estudio reciente, Mariscal et al. (2019) encontraron que el contagio del bostezo en los niños con TEA estaba relacionado positivamente con la concentración sanguínea de oxitocina, la hormona involucrada en el apego parental y social (Decety et al., 2016) y postuló que el contagio del bostezo en los niños con TEA puede estar relacionado con la media variable concentraciones de oxitocina en diferentes cohortes de estudio (Mariscal et al., 2019). Este hallazgo está en línea con la hipótesis de EBH que vincula las tasas de contagio del bostezo con el vínculo social, que puede reflejar el vínculo emocional.
Conclusión
Nuestro estudio se suma a la discusión sobre los mecanismos subyacentes al asimetría social en el contagio del bostezo (para una revisión crítica: ver Adriaense et al., 2020; Palagi et al., 2020), al mostrar que el contagio del bostezo probablemente esté asociado con una atención selectiva de abajo hacia arriba, más que de arriba hacia abajo. La atención de abajo hacia arriba está dirigida principalmente por la percepción sensorial del estímulo provocador, mientras que la atención selectiva de arriba hacia abajo es un proceso voluntario y sostenido en el que un elemento en particular se selecciona internamente y se enfoca o examina (Katsuki y Constantinidis, 2014). En este sentido, se escuchó el estímulo acústico (bostezo auditivo) emitido por el disparador y podría provocar una respuesta de bostezo en el receptor, aunque el receptor no prestaba ninguna atención visual voluntaria al disparador. Además, las tasas de respuesta al bostezo estaban moduladas socialmente, y el contagio auditivo del bostezo era más alto en las personas que estaban más fuertemente vinculadas entre sí. Por lo tanto, la atención selectiva de arriba hacia abajo no es el principal impulsor de la asimetría social observada en el contagio del bostezo, que parece ser un fenómeno impulsado por estímulos y relacionado con los procesos de atención de abajo hacia arriba. Se necesita más investigación para comprender si, y de qué manera, otras formas de atención o etapas de preatención pueden afectar el contagio del bostezo.
Declaración de disponibilidad de datos
El conjunto de datos utilizado para este estudio se proporciona en el Material complementario.
Declaración de ética
El estudio con participantes humanos fue revisado y aprobado por el Comitato di Bioetica dAteneo (Comité de Bioética de la Universidad) —Universidad de Turín (ref. .no. 451945).No se requirió consentimiento informado por escrito para participar en este estudio de acuerdo con la legislación nacional y los requisitos institucionales.
Contribuciones de los autores
IN y EP llevaron a cabo la recolección de datos y concibieron y redactaron el manuscrito. AZ ayudó con la recopilación de datos y la revisión de manuscritos, figuras y tablas. MG llevó a cabo análisis estadísticos y redactó la parte relacionada del manuscrito.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran ser interpretado como un posible conflicto de intereses.
Agradecimientos
Los autores desean agradecer al Prof. Roberto Barbuti y a la Prof. Cristina Giacoma por haber apoyado la investigación en la Universidad de Pisa y la Universidad de Turín, respectivamente.
Material suplementario
Altmann, J. (1974). Estudio observacional del comportamiento: métodos de muestreo. Behavior 49, 227–266. doi: 10.1163 / 156853974×00534
Resumen de PubMed | CrossRef Texto completo | Google Scholar
Anderson, J. R. y Meno, P. (2003). Influencias psicológicas sobre el bostezo en los niños. Curr. Psychol. Letón. 11, 1–7.
Google Scholar
Bartholomew, A. J. y Cirulli, E. T. (2014). La variación individual en la susceptibilidad contagiosa al bostezo es muy estable y en gran parte no se explica por la empatía u otros factores conocidos. PLoS One 9: e91773. doi: 10.1371 / journal.pone.0091773
Resumen de PubMed | CrossRef Texto completo | Google Académico
Bretz, F., Hothorn, T. y Westfall, P. (2010). Varias comparaciones con R. Boca Raton, FL: Chapman & Hall.
Google Scholar
Diputado, BL (1994). Estudio etológico del bostezo en primates. I. Análisis cuantitativo y estudio de causalidad en dos especies de monos del Viejo Mundo (Cercocebus albigena y Macaca fascicularis). Ethology 98, 221–245. doi: 10.1111 / j.1439-0310.1994.tb01073.x
CrossRef Full Text | Google Académico
Dobson, A. J. (2002). Introducción a los modelos lineales generalizados, 2ª ed. Boca Raton, FL: Chapman y Hall.
Google Scholar
Katsuki, F. y Constantinidis, C . (2014). Atención de abajo hacia arriba y de arriba hacia abajo: diferentes procesos y sistemas neuronales superpuestos. Neurocientist 20, 509–521. doi: 10.1177 / 1073858413514136
Resumen de PubMed | CrossRef Texto completo | Google Académico
Singer, T. (2006). La base neuronal y la ontogenia de la empatía y la lectura de la mente: revisión de la literatura e implicaciones para futuras investigaciones. Neurosci. Biobehav. Rev. 30, 855–863. doi: 10.1016 / j.neubiorev.2006.06.011
Resumen de PubMed | CrossRef Texto completo | Google Académico
Statistics Canada (2009). Categorías de edad, agrupaciones de ciclo de vida. Ottawa: Statistics Canada.
Google Scholar