El elemento químico lantano está clasificado como lantánido y metal de tierras raras. Fue descubierto en 1839 por Carl G. Mosander.

Zona de datos
| Clasificación: | El lantano es un lantánido y un metal de tierras raras |
| Color: | blanco plateado |
| Atómico peso: | 138.9055 |
| Estado: | sólido |
| Punto de fusión : | 1540 oC, 1813,2 K |
| Punto de ebullición: | 2830 oC, 3103 K |
| Electrones: | 57 |
| Protones: | 57 |
| Neutrones en el isótopo más abundante: | 82 |
| Capa de electrones: | 2,8,18,18, 9,2 |
| Configuración electrónica: | 5d1 6s2 |
| Densidad @ 20oC: | 6.16 g / cm3 |
Mostrar más, que incluye: Calores, Energías, Oxidación,
Reacciones , Compuestos, radios, conductividades
| Volumen atómico: | 22,5 cm3 / mol |
| Estructura: | hcp: hexagonal compactado |
| Dureza: | 2,5 mohs |
| Capacidad calorífica específica | 0,19 J g-1 K-1 |
| Calor de fusión | 6,20 kJ mol-1 |
| Calor de atomización | 414 kJ mol-1 |
| Calor de vaporización | 400 kJ mol-1 |
| Primera energía de ionización | 538,1 kJ mol-1 |
| Segunda energía de ionización | 1067 kJ mol-1 |
| Tercera energía de ionización | 1850 kJ mol-1 |
| Afinidad electrónica | 50 kJ mol-1 |
| Número mínimo de oxidación | 0 |
| Min. número de oxidación común | 0 |
| Número máximo de oxidación | 3 |
| Máx. oxidación común no. | 3 |
| Electronegatividad (escala de Pauling) | 1.1 |
| Polarizabilidad volumen | 31,1 Å3 |
| Reacción con aire | vigorosa, w / ht ⇒ La2O3 |
| Reacción con HNO3 15 M | leve, ⇒ La (NO3) 3 |
| Reacción con HCl 6 M | suave, ⇒ H2, LaCl3 |
| Reacción con NaOH 6 M | ninguno |
| Óxido ( s) | La2O3 |
| Hidruro (s) | LaH2, LaH3 |
| Cloruro (s) | LaCl3 |
| Radio atómico | 195 pm |
| Radio iónico (1+ ion) | – |
| Radio iónico (2+ ion) | – |
| Radio iónico (3+ iones) | 117,2 pm |
| Radio iónico (1 ion) | – |
| Radio iónico (2 iones) | – |
| Iónico radio (3 iones) | – |
| Conductividad térmica | 13,4 W m-1 K-1 |
| Conductividad eléctrica | 1,9 x 106 S m-1 |
| Punto de congelación / fusión: | 1540 oC, 1813,2 K |

El lantano se utiliza en muchas aplicaciones, como iluminación de estudio, baterías de portátiles, lentes de cámaras y baterías de automóviles híbridos.
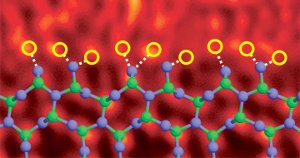
Límite de grano de nitruro de silicio dopado con átomos de lantano. Imagen Ref. (6)
Descubrimiento del lantano
El lantano fue descubierto en 1839 por Carl G. Mosander en el mineral cerita en Estocolmo, Suecia.
La ceria (óxido de cerio) ya había sido descubierta en 1803 por el químico sueco Jacob Berzelius en el mineral cerita. Mosander, que había sido uno de los estudiantes de Berzelius, sospechaba que la ceria era un óxido impuro que contenía otras tierras raras. (1)
Mosander tomó nitrato de cerio finamente pulverizado y añadió ácido nítrico diluido frío. Parte del polvo de nitrato de cerio disuelto en el ácido indica que podría haber tierra nueva. El nuevo óxido era más básico que la ceria (óxido de cerio) y, a diferencia de la ceria, se disolvió en el ácido.
Mosander separó la solución del precipitado usando oxalato de sodio y calor. Obtuvo un óxido de color ladrillo pálido de la nueva tierra rara. (1)
El nombre lanthana para el nuevo óxido fue sugerido por su amigo Berzelius.
El nombre proviene de la palabra griega lanthano que significa estar oculto.
Axel Erdmann descubrió el lantano de forma independiente el mismo año que Mosander en un mineral noruego recién descubierto. Erdmann llamó al nuevo mineral mosandrita, en honor a Mosander.(2)
Mosander obtuvo lantano metálico impuro a partir del cloruro. (1)
El metal de lantano puro se produjo por primera vez en 1923 mediante la electrólisis de los haluros fundidos por H. Kremers y R. Stevens.
Mosander continuó estudiando lantana y en 1841 anunció el descubrimiento de otra tierra rara contenida en él. Lo llamó «didimio» porque parecía ser «un hermano gemelo inseparable del lantano». (2)
Más tarde, en descubrimientos separados, se demostró que el «didimio» era una mezcla de elementos desconocidos de tierras raras. En 1879 Lecoq de Boisbaudran detectó samario en didimio y separó el samario de él. Carl Auer von Welsbach descubrió en 1885 que el «didimio» restante era en realidad una mezcla de dos elementos completamente nuevos: neodimio y praseodimio.


El lantano se utiliza en algunos productos para piscinas para reducir el nivel de fosfatos que alimentan algas.

En el sentido de las agujas del reloj desde el centro superior: óxidos de tierras raras de praseodimio, cerio, lantano, neodimio, samario y gadolinio. Foto: LLNL
Aspecto y características
Efectos nocivos:
Lantano y sus compuestos se consideran moderadamente tóxicos.
Características:
El lantano es un metal blando de color blanco plateado, que se puede cortar con un cuchillo.
Es dúctil , las superficies maleables y expuestas se empañan rápidamente en el aire formando el óxido.
El lantano reacciona con el agua para formar hidróxido de lantano más gas hidrógeno.
El lantano es químicamente reactivo y forma compuestos con carbono, nitrógeno , boro, selenio, silicio, fósforo, azufre y con los halógenos.
El lantano suele existir como un ion trivalente, La3 +, en sus compuestos.
Usos del lantano
El lantano se utiliza en grandes cantidades en baterías recargables de hidruro metálico de níquel (NiMH) para automóviles híbridos. El electrodo negativo (cátodo) de las baterías de NiMH es una mezcla de hidruros metálicos, uno de los cuales suele ser el hidruro de lantano. El material activo en el cátodo es hidrógeno, que se almacena en la estructura de hidruro metálico. El hidruro metálico puede, dependiendo de su composición, contener entre un 1% y un 7% en peso de hidrógeno. (3) Una batería Toyota Prius requiere alrededor de 10 kg de lantano. (4)
El lantano se utiliza como catalizador de craqueo del petróleo, catalizando la división de hidrocarburos de cadena larga en especies de cadena más corta.
El lantano se utiliza como aditivo para fabricar hierro fundido nodular y como aditivo en acero.
Los pedernales para encendedores de llamas usan misch metal (una aleación de tierras raras) que contiene lantano para producir chispas por fricción.
El lantano se usa en aleaciones de esponja de hidrógeno, que toman hasta 400 veces su propio volumen de gas hidrógeno.
El lantano también se utiliza para fabricar gafas de visión nocturna (vidrio absorbente de infrarrojos).
Las lentes de cámara y telescopio de alta calidad contienen óxido de lantano (La2O3) que utiliza su alto índice de refracción y baja dispersión.
El carbonato de lantano se usa para reducir los niveles sanguíneos de fosfato en pacientes con enfermedad renal. (5)
Los compuestos de lantano también se utilizan en algunos productos para piscinas para reducir el nivel de nutrientes de fosfato de los que se alimentan las algas.
Abundancia e isótopos
Abundancia de la corteza terrestre: 34 partes por millón por peso, 5 partes por millón por moles
Abundancia del sistema solar: 2 partes por billón por peso, 0.01 partes por mil millones por moles
Costo, puro: $ 800 por 100 g
Costo, a granel: $ por 100 g
Fuente: Lantano no se encuentra libre en naturaleza. Se encuentra principalmente en los minerales monacita y bastnaesita. Comercialmente, se recupera de arena de monacita y bastnaesita utilizando diversas técnicas de extracción complejas. El lantano puro se obtiene por reducción del fluoruro con calcio metal.
Isótopos: El lantano tiene 31 isótopos cuyas vidas medias son conocidas, con números de masa de 119 a 150. De estos, uno es estable, 139La. El lantano natural es una mezcla de los dos isótopos 138La y 139La con abundancias naturales de 0,09% y 99,91% respectivamente.

Citar esta página
Para vincular en línea, copie y pegue uno de los siguientes:
<a href="https://www.chemicool.com/elements/lanthanum.html">Lanthanum</a>
o
<a href="https://www.chemicool.com/elements/lanthanum.html">Lanthanum Element Facts</a>
Para citar esta página en un documento académico, utilice la siguiente cita compatible con MLA:
"Lanthanum." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/lanthanum.html>.