El término conducción aberrante se refiere al bloqueo de rama transitorio que no se debe a anomalías previas del QRS, conducción de la vía accesoria o efectos de fármacos no deseados. 1 El bloqueo puede ocurrir en cualquier nivel del sistema His-Purkinje y puede deberse a diferentes mecanismos. El bloqueo de fase 3 (dependiente de taquicardia) se debe a la invasión de tejido durante el período refractario efectivo y puede ser un fenómeno fisiológico o patológico. Una forma especial de este bloqueo es el bloqueo dependiente de la aceleración, que se debe a cambios en la frecuencia cardíaca. El bloqueo de fase 4 (dependiente de bradicardia o dependiente de pausa) es casi siempre patológico. Ocurre después del final del período refractario debido a la disminución del potencial de membrana, debido al aumento de la automaticidad de His-Purkinje o la despolarización parcial de la lesión miocárdica. El cuarto y último mecanismo aberrante se debe a la conducción oculta, que se define como la propagación de un impulso dentro del sistema de conducción específico y solo puede reconocerse por su efecto sobre el impulso, el intervalo o los ciclos siguientes.2 Como lo indica su nombre, este fenómeno no se puede observar en el electrocardiograma de superficie (ECG).
Presentamos el caso de una mujer de 86 años que ingresó en urgencias por palpitaciones y disnea. Unos años antes había sido valorada por un cardiólogo por bradicardia sinusal asintomática, por lo que no estaba recibiendo tratamiento. La exploración física reveló ruidos cardíacos irregulares de baja intensidad sin soplos y crepitantes bibasales sin otros hallazgos de interés. Al ingreso, el ECG mostró fibrilación auricular con respuesta ventricular en torno a 100 lpm, con bloqueo fascicular anterior izquierdo (LAFB), alternando con latidos con complejo QRS más estrecho (Figura 1A y Figura en el material complementario). Durante su estancia en urgencias, se le administró a la paciente 2,5 mg de atenolol por vía intravenosa y alcanzó ritmo sinusal a una frecuencia de 39 lpm, con normalización de la morfología del QRS (Figura 1B y Figura en el material complementario). El paciente fue dado de alta sin medicación antiarrítmica. A las 3 semanas ingresó con marcada astenia y bradicardia sinusal documentada a 35 lpm, por lo que recibió un marcapasos DDD.
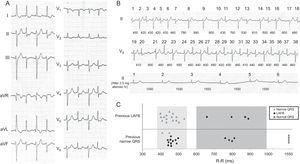
A: electrocardiógrafo de 12 derivaciones. B: Trazado completo de ECG al ingreso. Los latidos 1–38 son consecutivos a pesar de estar en 2 derivaciones diferentes (II y V5). La duración de los ciclos entre pulsos se muestra en milisegundos. El panel inferior muestra la morfología del QRS tras la administración intravenosa de 2,5 mg de atenolol y la conversión a ritmo sinusal. C: la relación de la morfología del QRS con la duración del ciclo y la morfología del latido anterior. LAFB, bloqueo fascicular anterior izquierdo.
Un análisis cuidadoso del ECG obtenido durante el episodio mostró claramente 2 tipos de QRS: a) QRS con morfología LAFB (120ms), alternando con b) QRS estrecho con pequeños variaciones en el eje y la duración (90-100 ms). Además, a intervalos R-R más largos, los latidos siempre tenían morfología LAFB. Se pueden diferenciar claramente dos áreas en la Figura 1C, que compara la morfología del QRS con la duración del ciclo y el complejo QRS previo3. En la zona 1 (R – R, 400-530 ms), la morfología del QRS depende del latido anterior , (es decir, si el tiempo anterior es estrecho, el siguiente tiempo tendrá morfología LAFB). Las únicas excepciones a esta regla son los latidos 32-33, que podrían explicarse por la penetración del impulso en la fase de conducción supranormal del fascículo anterior3,4. Sin embargo, en la zona 2 (R – R > 600ms), el complejo QRS siempre tiene morfología LAFB independientemente de la morfología del latido anterior, lo que sugiere un bloqueo dependiente de bradicardia. Lo curioso de este caso es que, a diferencia de lo que se esperaría en este tipo de bloqueo, tras un intervalo RR mucho más largo (> 1500ms), el QRS se normaliza.
La Figura 2 muestra el mecanismo propuesto para estos hallazgos. Con intervalos R – R cortos (zona 1), se produce un bloqueo anterógrado y retrógrado en el fascículo anterior, lo que hace que el siguiente impulso pueda conducir en sentido anterógrado ya que tiene tiempo de repolarizarse. De esta forma, las pequeñas variaciones en los complejos QRS estrechos podrían explicarse por su ocurrencia en diferentes momentos de su período refractario relativo, con mayor o menor grado de latencia (p. Ej., Latidos 3 y 7, o 13 y 15). Con ciclos muy largos, se produce la recuperación de tejido y la conducción anterógrada permanente. Cohen et al5 describieron este fenómeno a finales de la década de 1970 y lo denominaron bloqueo alternante de rama dependiente de pseudobradicardia (es decir, bloqueo de fase 3).Para que esto suceda, el período refractario efectivo retrógrado del fascículo anterior debe ser menor que el período refractario efectivo anterógrado y así favorecer la conducción retrógrada oculta4. = «28de12520e»>
A. Mecanismo propuesto de los hallazgos electrocardiográficos. Las barras negras representan los períodos refractarios efectivos teóricos y las líneas punteadas oblicuas representan la conducción interfascicular retrógrada oculta. B. Confirmación del mecanismo con estimulación auricular (AAI). FA, fascículo anterior; CL, duración del ciclo; FP, fascículo posterior; RB, rama derecha.
Pudimos confirmar este mecanismo (Figura 2B) porque a nuestro paciente se le había implantado un marcapasos DDD. LAFB alternada se produjo mediante estimulación AAI a 100 lpm, a 70 lpm todos los latidos se realizaron con morfología LAFB y a 60 lpm todos los latidos fueron estrechos, lo que confirmó el bloqueo dependiente de taquicardia.