La relación entre presión y volumen: Ley de Boyle
A medida que aumenta la presión sobre un gas, el volumen del gas disminuye porque las partículas de gas se acercan. Por el contrario, a medida que la presión sobre un gas disminuye, el volumen del gas aumenta porque la Las partículas de gas ahora pueden separarse más. Los globos meteorológicos se hacen más grandes a medida que se elevan a través de la atmósfera a regiones de menor presión porque el volumen del gas ha aumentado; es decir, el gas atmosférico ejerce menos presión sobre la superficie del globo, por lo que el el gas interior se expande hasta que las presiones interna y externa son iguales.
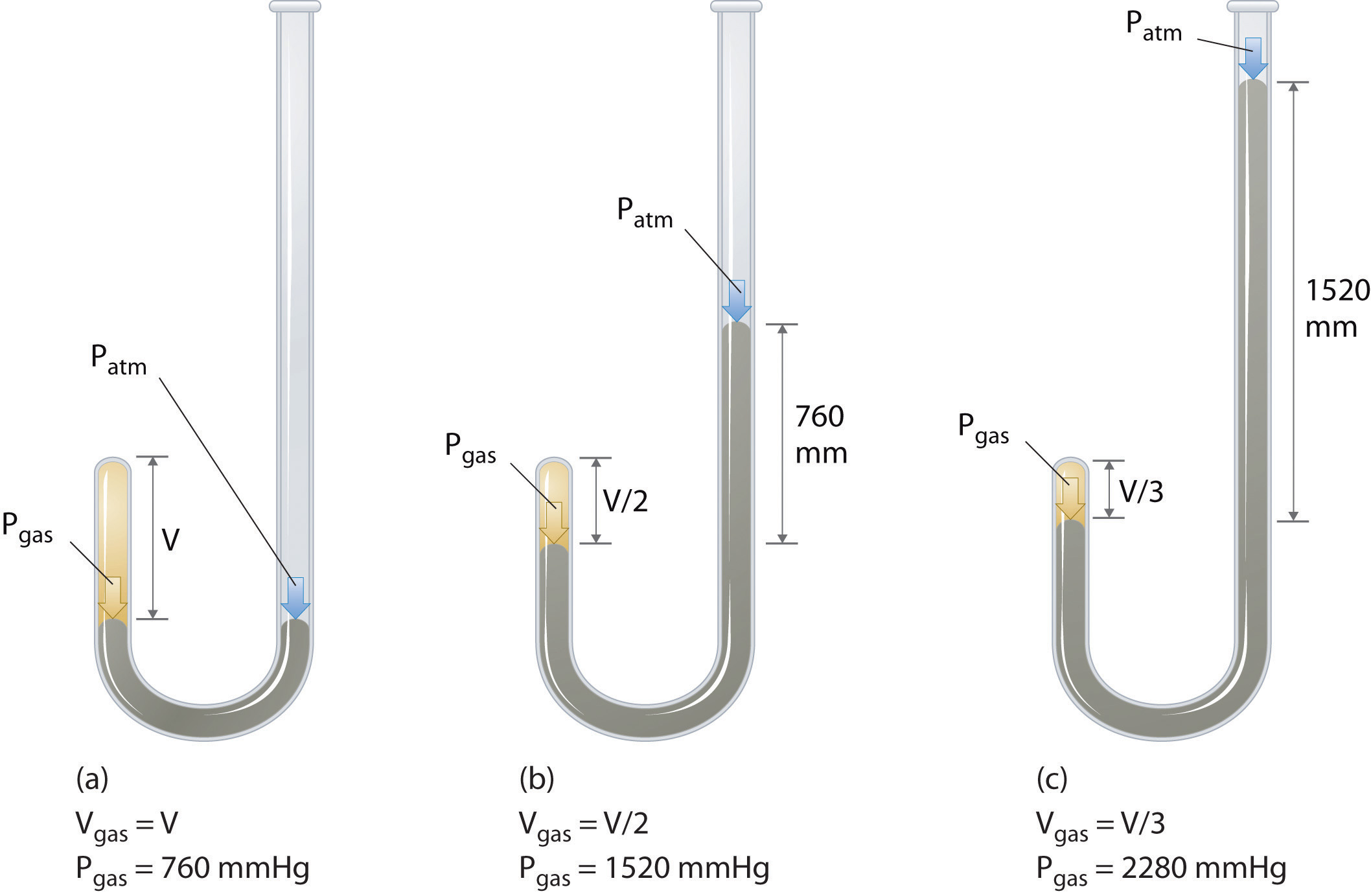
El químico irlandés Robert Boyle (1627-1691) llevó a cabo algunos de los primeros experimentos que determinaron la relación cuantitativa entre la presión y el volumen de un gas. Boyle usó un tubo en forma de J parcialmente lleno de mercurio, como se muestra en la Figura \ (\ PageIndex {1} \). En estos experimentos, una pequeña cantidad de gas o aire queda atrapada sobre la columna de mercurio, y su volumen se mide a presión atmosférica y temperatura constante. Luego se vierte más mercurio en el brazo abierto para aumentar la presión sobre la muestra de gas. La presión sobre el gas es la presión atmosférica más la diferencia en las alturas de las columnas de mercurio, y se mide el volumen resultante. Este proceso se repite hasta que no hay más espacio en el brazo abierto o el volumen del gas es demasiado pequeño para medirse con precisión. Los datos como los de uno de los experimentos del propio Boyle se pueden representar de varias formas (Figura \ (\ PageIndex {2} \)). Una gráfica simple de \ (V \) versus \ (P \) da una curva llamada hipérbola y revela una relación inversa entre la presión y el volumen: cuando la presión se duplica, el volumen disminuye en un factor de dos. Esta relación entre las dos cantidades se describe a continuación:
\
Dividir ambos lados por \ (P \) da una ecuación que ilustra la relación inversa entre \ (P \) y \ (V \):
\
o
\
donde el símbolo ∝ se lee «es proporcional a». Una gráfica de V contra 1 / P es, por tanto, una línea recta cuya pendiente es igual a la constante de las ecuaciones \ (\ ref {10.3.1} \) y \ (\ ref {10.3.3} \). Dividiendo ambos lados de La ecuación \ (\ ref {10.3.1} \) por V en lugar de P da una relación similar entre P y 1 / V. El valor numérico de la constante depende de la cantidad de gas utilizada en el experimento y de la temperatura a la que Los experimentos se llevan a cabo. Esta relación entre presión y volumen se conoce como ley de Boyle, en honor a su descubridor, y puede expresarse de la siguiente manera: A temperatura constante, el volumen de una cantidad fija de un gas es inversamente proporcional a su presión. La ley en la práctica se muestra en la Figura \ (\ PageIndex {2} \).
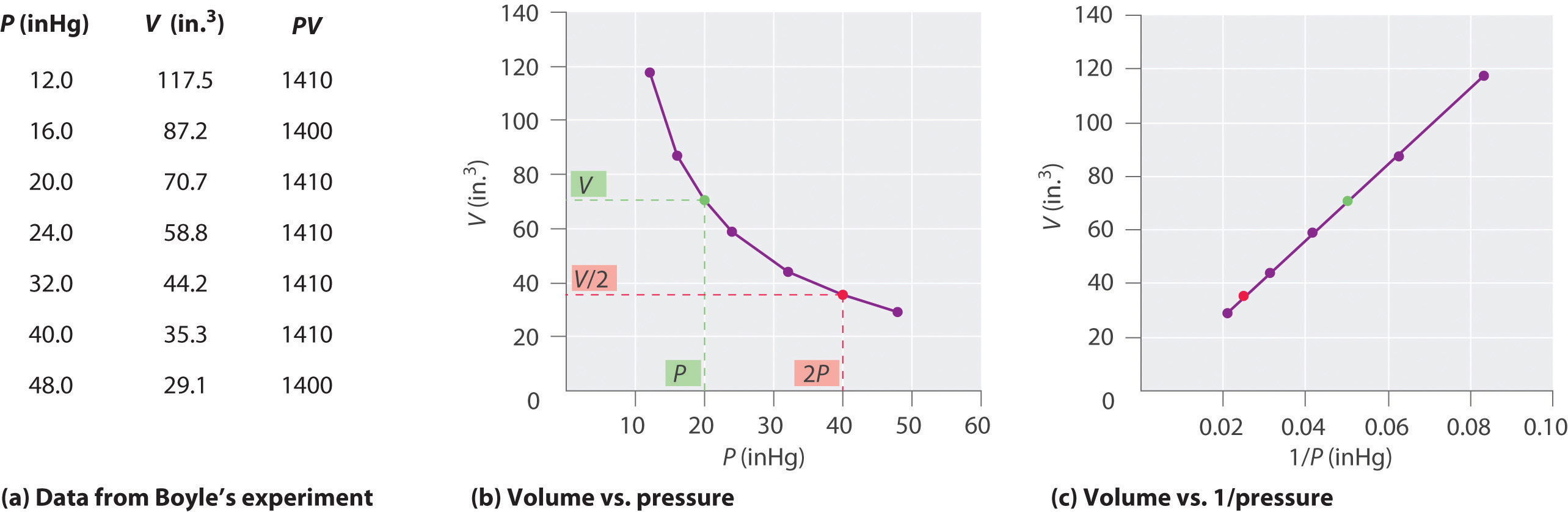
A temperatura constante, el volumen de una cantidad fija de un gas es inversamente proporcional a su presión