Lelemento chimico lantanio è classificato come lantanide e metallo delle terre rare. Fu scoperto nel 1839 da Carl G. Mosander.

Zona dati
| Classificazione: | Il lantanio è un lantanide e un metallo delle terre rare |
| Colore: | bianco-argento |
| Atomico peso: | 138.9055 |
| Stato: | solido |
| Punto di fusione : | 1540 oC, 1813,2 K |
| Punto di ebollizione: | 2830 oC, 3103 K |
| Elettroni: | 57 |
| Protoni: | 57 |
| Neutroni nellisotopo più abbondante: | 82 |
| Gusci di elettroni: | 2,8,18,18, 9,2 |
| Configurazione elettronica: | 5d1 6s2 |
| Densità a 20oC: | 6,16 g / cm3 |
Mostra altro, tra cui: calore, energia, ossidazione,
reazioni , Composti, raggi, conduttività
| Volume atomico: | 22,5 cm3 / mol |
| Struttura: | hcp: esagonale compatto |
| Durezza: | 2,5 mohs |
| Capacità termica specifica | 0,19 J g-1 K-1 |
| Calore di fusione | 6,20 kJ mol-1 |
| Calore di atomizzazione | 414 kJ mol-1 |
| Calore di vaporizzazione | 400 kJ mol-1 |
| 1a energia di ionizzazione | 538,1 kJ mol-1 |
| 2a energia di ionizzazione | 1067 kJ mol-1 |
| 3a energia di ionizzazione | 1850 kJ mol-1 |
| Affinità elettronica | 50 kJ mol-1 |
| Numero minimo di ossidazione | 0 |
| Min. numero di ossidazione comune | 0 |
| Numero massimo di ossidazione | 3 |
| Max. ossidazione comune n. | 3 |
| Elettronegatività (scala Pauling) | 1.1 |
| Polarizzabilità volume | 31,1 Å3 |
| Reazione con laria | vigorosa, con ⇒ La2O3 |
| Reazione con 15 M HNO3 | lieve, ⇒ La (NO3) 3 |
| Reazione con 6 M HCl | lieve, ⇒ H2, LaCl3 |
| Reazione con NaOH 6 M | nessuno |
| Ossido ( s) | La2O3 |
| Idruro / i | LaH2, LaH3 |
| Cloruro / i | LaCl3 |
| Raggio atomico | 195 pm |
| Raggio ionico (1+ ione) | – |
| Raggio ionico (2+ ione) | – |
| Raggio ionico (3+ ioni) | 117,2 pm |
| Raggio ionico (1 ione) | – |
| Raggio ionico (2 ioni) | – |
| Ionico raggio (3 ioni) | – |
| Conduttività termica | 13,4 W m-1 K-1 |
| Conduttività elettrica | 1,9 x 106 S m-1 |
| Punto di congelamento / fusione: | 1540 oC, 1813,2 K |

Il lantanio è utilizzato in molte applicazioni, come lilluminazione da studio, batterie per laptop, obiettivi per fotocamere e batterie per auto ibride.
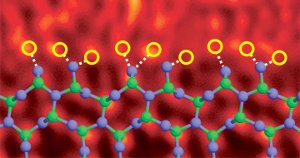
Nitruro di silicio bordo di grano drogato con atomi di lantanio. Immagine rif. (6)
Scoperta del lantanio
Il lantanio fu scoperto nel 1839 da Carl G. Mosander nel minerale cerite a Stoccolma, Svezia.
La ceria (ossido di cerio) era già stata scoperta nel 1803 dal chimico svedese Jacob Berzelius nel minerale cerite. Mosandro, che era stato uno degli studenti di Berzelius, sospettava che la ceria fosse un ossido impuro contenente altre terre rare. (1)
Mosander prese nitrato di cerio finemente in polvere e aggiunse acido nitrico diluito a freddo. Parte della polvere di nitrato di cerio disciolta nellacido indica che potrebbe essere presente una nuova terra. Il nuovo ossido era più basico del ceria (ossido di cerio) e, a differenza della ceria, disciolto nellacido.
Mosander ha separato la soluzione dal precipitato utilizzando ossalato di sodio e calore. Ha ottenuto un ossido color mattone chiaro della nuova terra rara. (1)
Il nome lanthana per il nuovo ossido è stato suggerito dal suo amico Berzelius.
Il nome deriva dalla parola greca “lanthano” che significa essere nascosto.
Axel Erdmann ha scoperto il lantanio in modo indipendente nello stesso anno di Mosander in un minerale norvegese appena scoperto. Erdmann chiamò il nuovo minerale mosandrite, in onore di Mosandro.(2)
Mosander ha ottenuto il lantanio metallico impuro dal cloruro. (1)
Il lantanio metallico puro fu prodotto per la prima volta nel 1923 mediante elettrolisi degli alogenuri fusi da H. Kremers e R. Stevens.
Mosander continuò a studiare lanthana e nel 1841 annunciò la scoperta di unaltra terra rara in essa contenuta. Lo chiamò “didimio” perché sembrava essere “un fratello gemello inseparabile del lantanio”. (2)
Il “didimio” fu successivamente dimostrato in scoperte separate come una miscela di sconosciuti elementi di terre rare. Nel 1879 Lecoq de Boisbaudran rilevò il samario nel didimio e ne separò il samario. Carl Auer von Welsbach scoprì nel 1885 che il “didimio” rimanente era in realtà una miscela di due elementi completamente nuovi: neodimio e praseodimio.


Il lantanio viene utilizzato in alcuni prodotti per piscine per ridurre il livello di nutrienti fosfatici che si nutrono alghe.

In senso orario dallalto al centro: ossidi di terre rare di praseodimio, cerio, lantanio, neodimio, samario e gadolinio. Foto: LLNL
Aspetto e caratteristiche
Effetti nocivi:
Lantanio e suoi composti sono considerati moderatamente tossici.
Caratteristiche:
Il lantanio è un metallo morbido bianco-argenteo, che può essere tagliato con un coltello.
È duttile , le superfici malleabili ed esposte si ossidano rapidamente nellaria formando lossido.
Il lantanio reagisce con lacqua per formare idrossido di lantanio più idrogeno gassoso.
Il lantanio è chimicamente reattivo e forma composti con carbonio, azoto , boro, selenio, silicio, fosforo, zolfo e con gli alogeni.
Il lantanio di solito esiste come ione trivalente, La3 +, nei suoi composti.
Usi del lantanio
Il lantanio è utilizzato in grandi quantità nelle batterie ricaricabili al nichel metallo idruro (NiMH) per le automobili ibride. Lelettrodo negativo (catodo) nelle batterie NiMH è una miscela di idruri metallici, uno dei quali è tipicamente idruro di lantanio. Il materiale attivo al catodo è lidrogeno, che è immagazzinato nella struttura di idruro di metallo. Lidruro metallico può, a seconda della sua composizione, contenere tra l1% e il 7% di idrogeno in peso. (3) Una batteria Toyota Prius richiede circa 10 kg di lantanio. (4)
Il lantanio è usato come catalizzatore di cracking del petrolio, catalizzando la scissione di idrocarburi a catena lunga in specie a catena più corta.
Il lantanio è usato come additivo per produrre ghisa nodulare e come additivo nellacciaio.
Le pietre focaie più leggere utilizzano metallo misch (una lega di terre rare) contenente lantanio per produrre scintille per attrito.
Il lantanio viene utilizzato nelle leghe di spugna di idrogeno, che richiedono fino a 400 volte il loro volume di idrogeno gassoso.
Il lantanio è anche usato per realizzare occhiali per la visione notturna (vetro che assorbe gli infrarossi).
Le lenti di alta qualità della fotocamera e del telescopio contengono ossido di lantanio (La2O3) che fa uso di il suo alto indice di rifrazione e la bassa dispersione.
Il carbonato di lantanio viene utilizzato per ridurre i livelli ematici di fosfato nei pazienti con malattie renali. (5)
I composti del lantanio sono utilizzati anche in alcuni prodotti per piscine per ridurre il livello di nutrienti fosfatici di cui si nutrono le alghe.
Abbondanza e isotopi
Abbondanza crosta terrestre: 34 parti per milione in peso, 5 parti per milione in moli
Abbondanza sistema solare: 2 parti per miliardo peso, 0,01 parti per miliardo in moli
Costo, puro: $ 800 per 100 g
Costo, sfuso: $ per 100 g
Fonte: Lantanio non è stato trovato libero in natura. Si trova principalmente nei minerali monazite e bastnaesite. Commercialmente, viene recuperato da sabbia monazite e bastnaesite utilizzando varie tecniche di estrazione complesse. Il lantanio puro si ottiene per riduzione del fluoruro con calcio metallico.
Isotopi: il lantanio ha 31 isotopi le cui emivite sono note, con numeri di massa da 119 a 150. Di questi, uno è stabile, 139La. Il lantanio naturale è una miscela dei due isotopi 138La e 139La con abbondanze naturali rispettivamente dello 0,09% e del 99,91%.

Cita questa pagina
Per il collegamento in linea, copia e incolla uno dei seguenti:
<a href="https://www.chemicool.com/elements/lanthanum.html">Lanthanum</a>
o
<a href="https://www.chemicool.com/elements/lanthanum.html">Lanthanum Element Facts</a>
Per citare questa pagina in un documento accademico, utilizza la seguente citazione conforme a MLA:
"Lanthanum." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/lanthanum.html>.