Eis schwimmt, weil es weniger dicht als Wasser ist. Wasser hat eine Dichte von 1,0 g / Kubikzentimeter.
Die Dichte von Eis Ih beträgt 0,931 g / Kubikzentimeter.
Aber warum ist Eis weniger dicht als Wasser, wenn beide hergestellt werden? von H2O-Molekülen?
————– > drehen sich auf ——– > – Spin-off
—— > Leerzeichenfüllung / cpk ——– > stick —- > Ball-and-Stick
Zum Drehen des Moleküls — > Linksklick und Ziehen
Zum Zoomen – > > Linksklick + Umschalttaste gedrückt halten Schaltfläche und vertikal ziehen
Jsmol-Menü — > > Rechtsklick
Versuche dies!!
Wechseln Sie zuerst zum Drahtmodell:
Klicken Sie mit der rechten Maustaste auf das Feld
Stil – > Schemata – – > Drahtmodell
Beschriftungsatome:
Stil – > Beschriftung — > Atomnummer
Messen Sie die folgenden Winkel:
< 415
< 512
< 213
< 314
So messen Sie Winkel: Halten Sie die linke Maustaste nach unten über das Atom und doppelklicken Sie auf Atom 1, ziehen Sie auf das zweite Atom (Zentralatom). ———— > drehen auf ——– > – drehen aus
—— > Leerzeichenfüllung / cpk ——– > stick —- > Ball-and-Stick
Flüssiges Wasser hat eine teilweise geordnete Struktur, in der sich ständig Wasserstoffbrückenbindungen bilden und Aufbrechen.
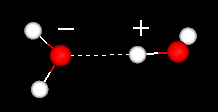
Andererseits hat Eis eine starre Gitterstruktur.
In flüssigem Wasser ist jedes Molekül an ungefähr 3,4 andere Wassermoleküle wasserstoffgebunden.
In Eis ist jedes Molekül an 4 andere Moleküle wasserstoffgebunden.
Vergleichen Sie die beiden folgenden Strukturen. Beachten Sie die leeren Stellen innerhalb der Eisstruktur.
 |
 |
In Eis Ih bildet sich jedes Wasser vier Wasserstoffbrücken mit O-O-Abständen von 2,76 Angström zum nächsten Sauerstoffnachbarn. Aufgrund der geordneten Struktur im Eis befinden sich weniger H20-Moleküle in einem bestimmten Volumenraum.
Versuchen Sie dies –
Versuchen Sie dies –
1) Messen Sie Die OO-Abstände zwischen zwei benachbarten Sauerstoffatomen im Eis sind in der obigen Struktur dargestellt.
Bitte geben Sie Ihre Antwort in das dafür vorgesehene Feld ein:
Im Gegensatz zu Eis – Wasser bei Raumtemperatur ist es in ständiger Bewegung – Wasserstoffbrückenbindungen werden ständig gebildet und aufgebrochen – klicken Sie hier, um Wassermoleküle in Bewegung zu sehen