Empirische Evidenz klärt Risikofaktoren, Ursachen und First-Line-Interventionen.
Jeffrey R. Strawn, MD
Klinisch Ausbilder in Psychiatrie, Abteilung für Psychiatrie, Medizinische Fakultät der Universität Cincinnati
Paul E. Keck Jr., Professor für Psychiatrie, Psychiatrie, Medizinische Fakultät der Universität Cincinnati, Präsident und CEO, Lindner Center of HOPE, Cincinnati, OH
Stanley N. Caroff, MD
Professor für Psychiatrie, Abteilung für Psychiatrie, Medizinische Fakultät der Universität von Pennsylvania, Chef der stationären Psychiatrie, Psychiatrie, Philadelphia VA Medical Zentrum
Diagnose und Behandlung des malignen neuroleptischen Syndroms (NMS) sind umstritten, da dieses potenziell lebensbedrohliche Syndrom selten ist und unterschiedlich dargestellt wird. Diese Faktoren erschweren die Bewertung von Behandlungen in kontrollierten klinischen Studien, und Daten zur relativen Wirksamkeit spezifischer Interventionen sind rar. Es kann jedoch möglich sein, rationale Behandlungsrichtlinien unter Verwendung empirischer klinischer Daten zu entwickeln.1,2
Dieser Artikel untersucht die Evidenz in Bezug auf 6 kontroverse Aspekte der NMS-Diagnose und -Behandlung:
• zuverlässigste Risikofaktoren
• NMS als Spektrumsstörung
• Was verursacht NMS?
• NMS ausgelöst durch Antipsychotika der ersten Generation gegenüber Antipsychotika der zweiten Generation
• Erstlinieninterventionen
• Neustart von Antipsychotika nach einer NMS-Episode.
GIBT ES ZUVERLÄSSIGE RISIKOFAKTOREN FÜR NMS?
In kleinen fallkontrollierten Studien waren Agitation, Dehydration und Erschöpfung die am häufigsten gefundenen systemischen Faktoren, von denen angenommen wurde, dass sie Patienten prädisponieren, die Antipsychotika gegen NMS einnehmen (Tabelle) 1) .3-5 Katatonie und organisches Gehirnsyndrom können getrennte Risikofaktoren sein.1,6
Vorläufige Studien haben auch Dopaminrezeptoranomalien impliziert, die durch genetische Polymorphismen oder Auswirkungen von Eisen im niedrigen Serum verursacht werden.1,7, 8 Pharmakologische Studien haben gezeigt, dass höhere Dosen, schnelle Titration und IM-Injektionen von Antipsychotika sind mit einem erhöhten NMS-Risiko verbunden.3,5 Einige Studien legen nahe, dass 15% bis 20% der NMS-Patienten in der Vorgeschichte NMS-Episoden hatten.1,2 Darüber hinaus hochwirksame Antipsychotika der ersten Generation (FGAs) – Insbesondere Haloperidol – es wird angenommen, dass es ein höheres Risiko birgt als niedrigwirksame Medikamente und Antipsychotika der zweiten Generation (SGAs), obwohl diese Hypothese schwer zu beweisen ist.9-11
Diese Risikofaktoren sind jedoch für die Abschätzung des NMS-Risikos nicht praktikabel bei einem bestimmten Patienten, weil sie im Vergleich zu dem geringen Risiko des Auftretens von NMS relativ häufig sind. Bei der überwiegenden Mehrheit der Patienten mit psychotischen Symptomen überwiegen die Vorteile einer ordnungsgemäß indizierten antipsychotischen Pharmakotherapie die Risiken.
Tabelle 1Was erhöht das NMS-Risiko?
- Bewegung
- Dehydration
- Erschöpfung
- Niedrige Serum-Eisenkonzentrationen (normal: 60 bis 170 mcg / dl)
Diagnosen
- Anamnese von NMS
- Katatonie
- Organische Gehirnsyndrome
Zentralnervensystem
- Dysfunktion des Dopaminrezeptors
- Dysfunktion der Basalganglien
- Dysfunktion des sympathischen Nervensystems
Pharmakologische Behandlung *
- Intramuskuläre oder intravenöse Injektionen
- Hochwirksame Dopaminantagonisten
- Schnelle Dosistitration
- Hohe Dosen
- FGAs im Vergleich zu SGAs (?)
* Für einzelne Patienten müssen diese häufigen Risikofaktoren erneut abgewogen werden, um die Vorteile einer antipsychotischen Therapie zu nutzen.
FGAs: Erstens Antipsychotika der Generation;
SGAs: Antipsychotika der zweiten Generation; NMS: malignes neuroleptisches Syndrom
Quelle: Referenzen 1-5
IST NMS IM ZUSAMMENHANG MIT PARKINSONISMUS, KATATONIE ODER MALIGNANTER HYPERTHERMIE?
Parkinsonismus. Einige Forscher haben NMS als eine extreme Parkinson-Krise beschrieben, die aus einer überwältigenden Blockade der Dopaminwege im Gehirn resultiert.1,2,12 In dieser Ansicht ähnelt NMS dem Parkinson-Hyperthermie-Syndrom, das bei Parkinson-Patienten nach abruptem Absetzen oder Verlust von auftreten kann Wirksamkeit der dopaminergen Therapie, die durch Wiedereinsetzung dopaminerger Mittel behandelt werden kann.13 Zu den Beweisen, die diese Ansicht stützen, gehören:
• Parkinson-Symptome sind ein Hauptmerkmal von NMS.
• Der Entzug von Dopaminagonisten führt zu einem Auslösen des Syndroms.
• Alle auslösenden Medikamente sind Dopaminrezeptorantagonisten.
• Das Risiko von NMS korreliert mit der Dopaminrezeptoraffinität der Medikamente.
• Dopaminerge Agonisten können eine wirksame Behandlung sein.
• Läsionen in dopaminergen Pfaden führen zu einem ähnlichen Syndrom.
• Patienten mit NMS haben niedrige Konzentrationen des Dopaminmetaboliten Homovanillinsäure in der Liquor cerebrospinalis nachgewiesen.14
Katatonie. Fink et al. 15 und andere 16-18 haben überzeugend argumentiert, dass NMS eine Form der medikamenteninduzierten malignen Katatonie darstellt. Zu den diesbezüglichen Hinweisen gehören:
• Die beiden Erkrankungen weisen neuropsychiatrische Symptome auf.
• Katatonische Symptome sind bei NMS häufig.19
• Maligne Katatonie und NMS teilen physiologische und Laborzeichen.20
• Die Wiedereinführung von Antipsychotika kann beide Zustände akut verschlechtern.
• Benzodiazepine und Elektrokrampftherapie (ECT) ) sind wirksame Behandlungen für beide Erkrankungen.15-18
Lee21 untersuchte die Beziehung zwischen katatonischen Merkmalen und dem Ansprechen auf die Behandlung bei 14 NMS-Patienten. Die meisten Patienten mit katatonischen Symptomen sprachen auf Benzodiazepine an, während keiner der Patienten eine extrapyramidal-hyperthermische Darstellung ohne Katatonie aufwies. Lee kam zu dem Schluss, dass NMS heterogen ist und in katatonischen und nichtkatatonischen Formen auftreten kann, die sich im Ansprechen auf die Behandlung unterscheiden.
Maligne Hyperthermie. Einige Kliniker haben NMS mit maligner Hyperthermie verglichen, die durch Inhalationsanästhetika und Succinylcholin verursacht wird.1,2 Zu den Nachweisen gehören:
• ähnliche klinische Anzeichen von Rigidität, Hyperthermie und Hypermetabolismus
• ähnliche physiologische und Laborzeichen wie Rhabdomyolyse
• Hyperthermie bei beiden, die auf Dantrolen ansprechen.
Obwohl die beiden ähnlich aussehen, tritt die maligne Hyperthermie intraoperativ auf und spiegelt eine pharmakogenetische Störung der Kalziumregulation im Skelettmuskel wider. Darüber hinaus reagiert die Rigidität bei maligner Hyperthermie nicht auf peripher wirkende Muskelrelaxantien.1,22 Es gibt Hinweise darauf, dass bei Patienten, bei denen zuvor eine NMS-Episode aufgetreten ist, kein Risiko für maligne Hyperthermie besteht.22
WAS IST DIE PATHOPHYSIOLOGIE? OF NMS?
Die Pathophysiologie von NMS ist komplex und beinhaltet wahrscheinlich das Zusammenspiel mehrerer zentraler und systemischer Pfade und Neurotransmitter. Wie oben beschrieben, deuten überzeugende Beweise darauf hin, dass die Dopaminblockade eine zentrale Rolle spielt.12 Es wird angenommen, dass die Dopaminblockade im Hypothalamus zum thermoregulatorischen Versagen beiträgt, und die Blockade im Nigrostriatalsystem trägt wahrscheinlich zur Muskelsteifheit und zum Hypermetabolismus bei. Der Verlust des dopaminergen Inputs in den anterioren cingulat-medialen orbitofrontalen Kreislauf und den lateralen orbitofrontalen Kreislauf trägt wahrscheinlich zu den Veränderungen des mentalen Status und den katatonischen Merkmalen bei, die bei NMS beobachtet werden. 12
Einige Forscher haben jedoch konkurrierende oder komplementäre Hypothesen vorgeschlagen. Zum Beispiel schlug Gurrera 23 vor, dass Patienten, die zur Entwicklung von NMS neigen, anfällig für ein hyperaktives und dysreguliertes sympathisches Nervensystem sind, und dieses Merkmal – zusammen mit einer durch Dopaminblocker verursachten Störung des Dopaminsystems – NMS produziert. Andere Forscher haben Serotonin-, Noradrenalin-, Gamma-Aminobuttersäure- und glutaminerge Mechanismen in Betracht gezogen. 1,12,24,25
FGAS ODER SGAS MÖGLICHER, NMS ZU VERURSACHEN?
FGA: Antipsychotikum der ersten Generation
SGA: Antipsychotikum der zweiten Generation
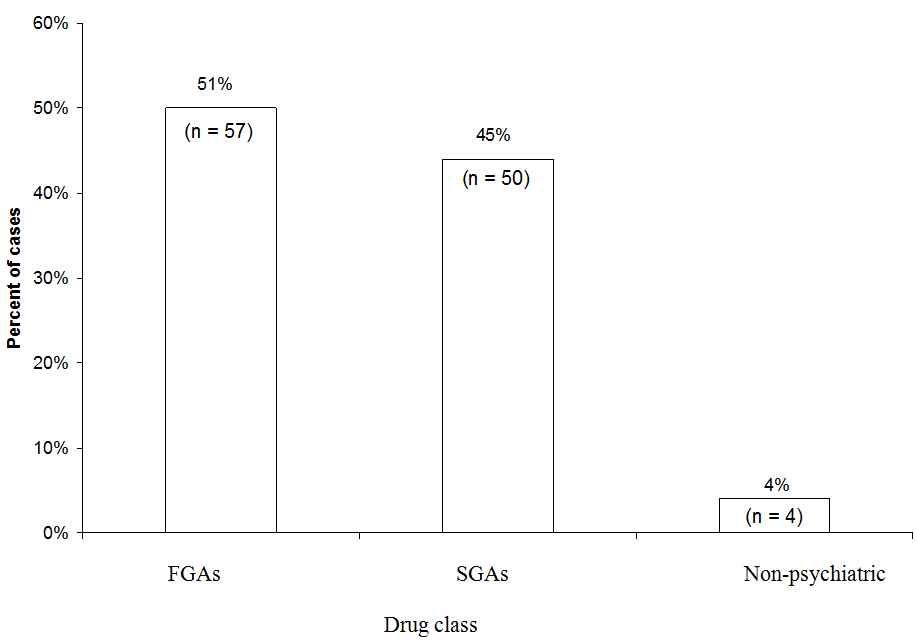
Leicht In einer Analyse von 111 Fällen von wahrscheinlichem oder definitivem NMS im Zusammenhang mit einem einzelnen Arzneimittel, die von 1997 bis 2006 an die NMS-Hotline gemeldet wurden, wurden mehr NMS-Fälle FGAs (51%) als SGAs (45%) zugeordnet. Das FGA-Haloperidol machte 44% aus aller Fälle. „Medizinisch“ bezieht sich auf Fälle, in denen ein Neuroleptikum in einem nicht-psychiatrischen Umfeld angewendet wurde.
Quelle: Unveröffentlichte Daten, die beim Informationsdienst für das maligne neuroleptische Syndrom hinterlegt sind.
NMS bei Patienten, die mit SGAs behandelt werden, weniger häufig auftritt als bei Patienten, die FGAs erhalten, obwohl diese Hypothese nicht bewiesen ist. Isolierte Berichte über NMS wurden mit fast jeder SGA in Verbindung gebracht.9-11 Es ist schwierig, FGA- und SGA-Verbindlichkeiten nachzuweisen, weil:
• NMS selten ist.
• Dosierungspraktiken sind derzeit möglicherweise konservativer als in der Vergangenheit.
• Die meisten Kliniker sind sich der frühen Anzeichen von bewusst NMS.
In einer epidemiologischen Studie einer großen Datenbank stellten Stubner et al. 26 fest, dass Patienten, die SGAs erhielten, ein geringeres Risiko für NMS hatten als Patienten, die mit Haloperidol behandelt wurden. 26 In dieser Studie betrug die Gesamtrate von NMS 0,02%.
NMS-Hotline-Daten. Wir haben kürzlich untersucht, welche Medikamentenklassen in 111 NMS-Fällen verwickelt waren, die dem Neuroleptic Malignant S gemeldet wurden Hotline des yndrome Information Service (1-888-NMSTEMP) zwischen 1997 und 2006 (Abbildung). Wir haben nur Fälle von bestimmten oder wahrscheinlichen NMS (wie von Hotline-Beratern diagnostiziert) eingeschlossen, in denen ein einzelnes Antipsychotikum verabreicht wurde. Etwas mehr Fälle wurden FGAs (51%) als SGAs (45%) zugeschrieben. Die verbleibenden Fälle wurden Neuroleptika zugeschrieben, die in medizinischen Einrichtungen eingesetzt wurden (wie Promethazin oder Prochlorperazin).
Da sie jetzt seltener verschrieben werden, entfielen auf FGAs überproportional viele NMS-Fälle, die der Hotline gemeldet wurden. Haloperidol machte die Mehrheit der FGA-Fälle und 44% aller Fälle aus. Wenn wir Haloperidol ausgeschlossen und das NMS-Risiko von SGAs mit nur FGAs mittlerer oder niedriger Potenz verglichen hätten, wäre der relative Vorteil von SGAs verloren gegangen. Andererseits ist klar, dass SGAs immer noch ein Risiko für NMS bergen.
Analysen legen nahe, dass die SGA-assoziierten klassischen Merkmale von NMS – Fieber, Muskelsteifheit sowie autonome und mentale Statusänderungen – bei Patienten, die SGAs erhalten, beibehalten werden, obwohl einige möglicherweise nicht die schwere Starrheit und die extremen Temperaturen entwickeln, die bei Patienten, die FGAs erhalten, üblich sind .9-11 Die milderen klinischen Merkmale, die mit SGAs verbunden sind, können konservativere Verschreibungsmuster oder ein erhöhtes Bewusstsein und eine frühere Erkennung von NMS widerspiegeln, was fulminante Präsentationen verhindern würde.
WAS IST DER BEWEIS FÜR SPEZIFISCHE NMS-BEHANDLUNGEN?
NMS ist selten, seine Darstellung variiert und sein Fortschritt ist unvorhersehbar. Diese Faktoren erschweren die Bewertung von Behandlungen in kontrollierten klinischen Studien, und Daten zur relativen Wirksamkeit spezifischer Interventionen sind rar.
Trotzdem lässt die Vorstellung, dass NMS eine extreme Variante des medikamenteninduzierten Parkinsonismus oder der Katatonie darstellt, auf ein spezifisches NMS schließen Die Behandlungen können auf der Schwere der Symptome oder dem Stadium der Präsentation basieren. Wir schlagen eine Behandlungsrichtlinie vor, die auf theoretischen Mechanismen und anekdotischen Daten basiert.2,27-29
Unterstützung. Nach dem sofortigen Absetzen des betreffenden Medikaments ist die unterstützende Therapie der Eckpfeiler der NMS-Behandlung.1,2,27
Bei Patienten mit leichten Anzeichen und Symptomen kann eine unterstützende Behandlung und eine sorgfältige klinische Überwachung ausreichend sein. Extreme Hyperthermie erfordert Volumenreanimations- und Kühlmaßnahmen, intensive medizinische Versorgung und sorgfältige Überwachung auf Komplikationen.
Behandlung. Trotz mangelnder Übereinstimmung bei der medikamentösen Behandlung von unkompliziertem NMS erhalten ungefähr 40% der Patienten mit akutem NMS pharmakologische Behandlungen.2
Lorazepam, 1 bis 2 mg parenteral, ist eine vernünftige Erstlinientherapie für NMS, insbesondere bei Personen mit katatonische Merkmale.4,15-18,21,30,31 Einige Forscher empfehlen höhere Dosen.15 Benzodiazepine werden bevorzugt, wenn bei erregten NMS-Patienten eine Sedierung erforderlich ist.4,15-18
Dopaminerge Mittel wie Bromocriptin und Amantadin verstärken die Dopaminerge Die Übertragung auf umgekehrte Parkinson-Symptome verkürzt die Zeit bis zur Genesung und halbiert die Sterblichkeitsrate, wenn sie allein oder in Verbindung mit anderen Behandlungen angewendet wird.13,27,32,33 Ein schnelles Absetzen dieser Wirkstoffe kann zu Rebound-Symptomen führen, obwohl dies der Fall sein kann Dies gilt für jede spezifische medikamentöse Behandlung von NMS.1,31,32
Dantrolen entkoppelt die Anregungs-Kontraktions-Kopplung durch Verbesserung der Calcium-Sequestrierung im sarkoplasmatischen Retikulum im Skelettmuskel zur Behandlung von hypermetabolischen NMS-Symptomen. Einige Untersuchungen ergaben eine Verbesserung bei bis zu 80% der mit Dantrolen-Monotherapie behandelten NMS-Patienten.27,32-35 Im Vergleich zur unterstützenden Behandlung kann sich die Zeit bis zur Genesung verkürzen – und die Mortalität um fast die Hälfte verringern -, wenn Dantrolen allein oder in Dantrolen angewendet wird Kombination mit anderen Medikamenten.
Nicht alle Fallberichte haben gezeigt, dass Dantrolen, Benzodiazepine oder dopaminerge Agonisten bei der Behandlung von NMS wirksam sind.31,36 Unserer Meinung nach sind nur fortgeschrittene NMS-Fälle – mit extremen Temperaturerhöhungen – schwerwiegend Starrheit und Hinweise auf systemischen Hypermetabolismus – Nutzen der Dantrolen-Behandlung.1,2
ECT wurde erfolgreich eingesetzt, um die Mortalität durch NMS und andere Störungen des katatonischen Spektrums zu senken. Es wird normalerweise angewendet, nachdem eine unterstützende Therapie und psychopharmakologische Interventionen fehlgeschlagen sind.2,15,16,27,37 Die ECT für akutes NMS besteht typischerweise aus einer Reihe von 6 bis 10 Behandlungen mit bilateraler Elektrodenplatzierung. Eine tägliche ECT kann anfänglich erforderlich sein.15
SIND ANTIPSYCHOTIKEN NACH EINER NMS-EPISODE KONTRAINDIZIERT?
Die Rate des Wiederauftretens von NMS bei erneuter Behandlung mit einem Antipsychotikum ist unterschiedlich.38 Wir schätzen, dass bis zu 30 Bei% der Patienten besteht möglicherweise das Risiko eines erneuten Auftretens von NMS, wenn sie erneut mit einem Antipsychotikum behandelt werden.1 Durch Befolgen der entsprechenden Vorsichtsmaßnahmen (Tabelle 2) können Sie jedoch die meisten Patienten, die eine fortgesetzte Antipsychotika-Therapie benötigen, sicher behandeln.1,2
Wenn Sie die Behandlung erneut beginnen Laut retrospektiven Analysen begrenzter verfügbarer Daten kann ein Antipsychotikum mit niedrigerer Wirksamkeit aus einer anderen chemischen Klasse eine sicherere Option sein als ein erneuter Versuch des Auslösers. Ein Patient, der NMS auf einer FGA entwickelt, kann von einer SGA-Studie profitieren, obwohl das Risiko eines erneuten Auftretens weiterhin besteht.1,10
Tabelle 2Einführung von Antipsychotika nach einer NMS-Episode
Überprüfen Sie die Genauigkeit der Diagnose einer früheren NMS-Episode erneut.
Dokumentindikationen für Antipsychotika
Besprechen Sie Risiken und Vorteile, einschließlich des Risikos eines erneuten Auftretens, mit dem Patienten und der Familie
Erwägen Sie alternative pharmakologische Wirkstoffe
Minimieren Sie die Risikofaktoren (Tabelle 1).
Warten Sie ≥2 Wochen (≥4 Wochen für injizierbare Langzeitmedikamente), nachdem eine NMS-Episode behoben ist, bevor Sie sie erneut herausfordern.
Wählen Sie FGAs oder SGAs mit niedriger Potenz aus.
Verschreiben Sie eine anfängliche Testdosis.
Überwachen Sie die Vitalfunktionen und den neurologischen Status.
Titrieren Sie Dosierungen schrittweise
FGAs: Antipsychotika der ersten Generation;
SGAs: Antipsychotika der zweiten Generation
Quelle: Referenzen 1,2
Verwandte Ressourcen
• Informationsdienst für das neuroleptische maligne Syndrom. www.nmsis.org.
• Zarrouf FA, Bhanot V. Malignes neuroleptisches Syndrom: Lassen Sie Ihre Wache noch nicht los. Current Psychiatry 2007; 6 (8): 89-95.
Markennamen für Arzneimittel
Amantadin • Symmetrel
Bromocriptin • Parlodel
Chlorpromazin • Thorazin
Dantrolen • Dantrium®
Fluphenazin • Prolixin
Haloperidol • Haldol
Lorazepam • Ativan
Loxapin • Loxitan
Perphenazin • Trilafon
Prochlorperazin • Compazin, Compro
Promethazin • Phenergan
Thioridazin • Mellaril
Offenlegung
Dr. Strawn ist ein amerikanisches psychiatrisches Institut für Forschung und Lehre (APIRE) / Janssen-Stipendiat.
Dr. Keck erhielt Forschungsunterstützung von Abbott Laboratories, der American Diabetes Association, AstraZeneca Pharmaceuticals, Bristol-Myers Squibb, GlaxoSmithKline, Eli Lilly und Company, Janssen Pharmaceutica, dem Nationalen Institut für psychische Gesundheit und dem National Institute of Drug Abuse, Pfizer , Stanley Medical Research Institute und UCB Pharma.
Dr. Caroff erhielt Forschungsunterstützung von Bristol-Myers Squibb, Ortho-McNeil Neurologics und Pfizer.
- Caroff SN. Malignes neuroleptisches Syndrom. In: Mann SC, Caroff SN, Keck PE Jr., Lazarus A., Hrsg. Malignes neuroleptisches Syndrom und verwandte Erkrankungen 2. Aufl. Washington, DC: American Psychiatric Publishing Inc; 2003; 1-44.
- Strawn JR, Keck PE Jr., Caroff SN. Malignes neuroleptisches Syndrom Am J Psychiatry 2007; 164: 870–6. Keck PE Jr., Pope HG Jr., Cohen BM, et al. Risikofaktoren für das maligne neuroleptische Syndrom Arch Gen Psychiatry 1989; 46: 914–18.
- Rosebush PI, Stewart TD. Eine prospektive Analyse von 24 Episoden des malignen neuroleptischen Syndroms Am J Psychiatry 1989; 146: 717–25. Berardi D., Amore M., Keck PE Jr., Et al. Klinische und pharmakologische Risikofaktoren für das maligne neuroleptische Syndrom: eine Fall-Kontroll-Studie. Biol Psychiatry 1998; 44: 748–54. White DA, Robins AH. Katatonie: Vorbote des malignen neuroleptischen Syndroms Br J Psychiatry 1991; 158: 419–21. Rosebush PI, Mazurek MF. Serumeisen und malignes neuroleptisches Syndrom. Lancet 1991; 338: 149–51. Lee JW. Serumeisen bei Katatonie und malignem neuroleptischem Syndrom Biol Psychiatry 1998; 44: 499–507.
- Ananth J., Parameswaran S., Gunatilake S., et al. Malignes neuroleptisches Syndrom und atypische Antipsychotika J Clin Psychiatry 2004; 65: 464–70. Caroff SN, Mann SC, Campbell EC. Atypische Antipsychotika und malignes neuroleptisches Syndrom Psychiatr Ann 2000; 30: 314–21.
- Hasan S., Buckley P. Neuartige Antipsychotika und das maligne neuroleptische Syndrom Am J Psychiatry 1998; 155: 1113–16.
- Mann SC, Caroff SN, Fricchione G., Campbell EC. Zentrale Dopaminhypoaktivität und die Pathogenese des malignen neuroleptischen Syndroms Psychiatr Ann 2000; 30: 363–74.
- Faktor SA, Santiago A. Parkinsonismus-Hyperpyrexie-Syndrom bei Parkinson. In: Frucht SJ, Fahn S, Hrsg . Bewegungsstörungen Notfälle: Diagnose und Behandlung. Totowa, NJ: Humana Press; 2005; 29-40.
- Nisijima K, Ishiguro T. Cerebrospinalflüssigkeitsspiegel von Monoaminmetaboliten und Gamma-Aminobuttersäure beim malignen neuroleptischen Syndrom. J Psychiatr Res 1995; 27: 233–44.
- Fink M, Taylor MA. Das maligne neuroleptische Syndrom ist eine maligne Katatonie, die eine wirksame Behandlung der Katatonie rechtfertigt. Prog Neuropsychopharmacol Biol Psychiatry 2006; 30: 1182–3.
- Fricchione G., Bush G., Fozdar M. et al. Erkennung und Behandlung des katatonischen Syndroms. J Intensive Care Med 1997; 12: 135–47.
- Philbrick KL, Rummans TA. Bösartige Katatonie. J Neuropsychiatry Clin Neurosci 1994; 6: 1–13. Mann SC, Caroff SN, Bleier HR, et al. Tödliche Katatonie. Am J Psychiatry 1986; 143: 1374–81. Koch M., Chandragiri S., Rizvi S. et al. Katatonische Zeichen beim malignen neuroleptischen Syndrom. Compr Psychiatry 2000; 41: 73–5. Lee JW. Laborbefunde. In: Caroff SN, Mann SC, Francis A., Fricchoine GL, Hrsg. Katatonie: Von der Psychopathologie zur Neurobiologie Washington, DC: American Psychiatric Press, Inc; 2004; 65-75. Lee JW.Katatonische Varianten, hyperthermische extrapyramidale Reaktionen und Subtypen des malignen neuroleptischen Syndroms. Ann Clin Psychiatry 2007; 19: 9–16.
- Caroff SN, Rosenberg H., Mann SC, et al. Malignes neuroleptisches Syndrom im perioperativen Umfeld. Am J Anesthesiol 2001; 28: 387–93.
- Gurrera RJ. Sympathoadrenale Hyperaktivität und die Ätiologie des malignen neuroleptischen Syndroms. Am J Psychiatry 1999; 156: 169–80. Carroll BT. Die universelle Feldhypothese der Katatonie und des malignen neuroleptischen Syndroms. CNS Spectr 2000; 5: 26–33.
- Weller M, Kornhuber J. Eine Begründung für die Therapie mit NMDA-Rezeptorantagonisten des malignen neuroleptischen Syndroms. Med Hypotheses 1992; 38: 329–33.
- Stubner S., Rustenbeck E., Grohmann R., et al. Schwere und ungewöhnliche unwillkürliche Bewegungsstörungen durch Psychopharmaka. Pharmacopsychiatry 2004; 37 (Supplement 1): S54 – S64.
- Davis JM, Caroff SN, Mann SC. Behandlung des malignen neuroleptischen Syndroms. Psychiatr Ann 2000; 30: 325–31.
- Adityanjee PA, Singh S., Singh G., Ong S. Spektralkonzept des malignen neuroleptischen Syndroms. Br J Psychiatry 1988; 153: 107–11. Woodbury MM, Woodbury MA. Neuroleptisch induzierte Katatonie als Stadium des Fortschreitens zum malignen neuroleptischen Syndrom. J Am Acad Child Adolesc Psychiatry 1992; 31: 1161–4. Francis A., Chondragivi S., Rizvi S. et al. Ist Lorazepam eine Behandlung für das maligne neuroleptische Syndrom? CNS Spectr 2000; 5: 54–7. Rosebush PI, Stewart T., Mazurek MF. Die Behandlung des malignen neuroleptischen Syndroms. Sind Dantrolen und Bromocriptin nützliche Hilfsmittel zur unterstützenden Pflege? Br J Psychiatry 1991; 159: 709–12.
- Sakkas P, Davis JM, Janicak PG, Wang ZY. Arzneimittelbehandlung des malignen neuroleptischen Syndroms. Psychopharmacol Bull 1991; 27: 381–4.
- Rosenberg MR, Green M. Malignes neuroleptisches Syndrom: Überprüfung des Ansprechens auf die Therapie. Arch Intern Med 1989; 149: 1927–31. Yamawaki S., Morio M., Kazamutsuri G. et al. Klinische Bewertung und effektive Anwendung von Dantrolen-Natrium beim malignen neuroleptischen Syndrom. Kiso to Rinsyou (Clinical Reports) 1993; 27: 1045–66. Tsutsumi Y., Yamamoto K., Matsuura S. et al. Die Behandlung des malignen neuroleptischen Syndroms mit Dantrolen-Natrium. Psychiatry Clin Neurosci 1998; 52: 433–8.
- Reulbach U., Dutsch C., Biermann T. et al. Management einer wirksamen Behandlung für das maligne neuroleptische Syndrom. Crit Care 2007; 11: R4.
- Troller JN, Sachdev PS. Elektrokrampfbehandlung des malignen neuroleptischen Syndroms: eine Überprüfung und ein Bericht von Fällen. Aust N Z J Psychiatry 1999; 33: 650–9.
- Papst HG, Aizley HG, Keck PE Jr., McElroy SL. Malignes neuroleptisches Syndrom: Langzeit-Follow-up von 20 Fällen. J Clin Psychiatry 1991; 52: 208–12.