Das chemische Element Lanthan wird als Lanthanoid und Seltenerdmetall eingestuft. Es wurde 1839 von Carl G. Mosander entdeckt.

Datenzone
| Klassifizierung: | Lanthan ist ein Lanthanid- und Seltenerdmetall. |
| Farbe: | silberweiß |
| Atomic Gewicht: | 138.9055 |
| Zustand: | fest |
| Schmelzpunkt : | 1540 oC, 1813,2 K |
| Siedepunkt: | 2830 oC, 3103 K |
| Elektronen: | 57 |
| Protonen: | 57 |
| Neutronen in den am häufigsten vorkommenden Isotopen: | 82 |
| Elektronenhüllen: | 2,8,18,18, 9,2 |
| Elektronenkonfiguration: | 5d1 6s2 |
| Dichte bei 20 ° C: | 6,16 g / cm3 |
Mehr anzeigen, einschließlich: Hitze, Energien, Oxidation,
Reaktionen , Verbindungen, Radien, Leitfähigkeiten
| Atomvolumen: | 22,5 cm3 / mol |
| Struktur: | hcp: hexagonal dicht gepackt |
| Härte: | 2,5 Mohs |
| Spezifische Wärmekapazität | 0,19 J g-1 K-1 |
| Schmelzwärme | 6,20 kJ mol-1 |
| Zerstäubungswärme | 414 kJ mol-1 |
| Wärme von Verdampfung | 400 kJ mol-1 |
| 1. Ionisierungsenergie | 538,1 kJ mol-1 |
| 2. Ionisierungsenergie | 1067 kJ mol-1 |
| 3. Ionisierungsenergie | 1850 kJ mol-1 |
| Elektronenaffinität | 50 kJ mol-1 |
| Minimale Oxidationszahl | 0 |
| min. gemeinsame Oxidationsnummer | 0 |
| Maximale Oxidationszahl | 3 |
| Max. gemeinsame Oxidation Nr. | 3 |
| Elektronegativität (Pauling-Skala) | 1.1 |
| Polarisierbarkeit Volumen | 31,1 Å3 |
| Reaktion mit Luft | heftig, w / ht ⇒ La2O3 |
| Reaktion mit 15 M HNO3 | mild, ⇒ La (NO3) 3 |
| Reaktion mit 6 M HCl | mild, ⇒ H2, LaCl3 |
| Reaktion mit 6 M NaOH | keine |
| Oxid ( s) | La2O3 |
| Hydrid (e) | LaH2, LaH3 |
| Chlorid (e) | LaCl3 |
| Atomradius | 195 pm |
| Ionenradius (1+ Ion) | – |
| Ionenradius (2+ Ion) | – |
| Ionenradius (3+ Ionen) | 117,2 pm |
| Ionenradius (1-Ion) | – |
| Ionenradius (2-Ionen) | – |
| Ionen Radius (3-Ionen) | – |
| Wärmeleitfähigkeit | 13,4 W m-1 K-1 |
| Elektrische Leitfähigkeit | 1,9 x 106 S m-1 |
| Gefrier- / Schmelzpunkt: | 1540 oC, 1813,2 K |

Lanthan wird in vielen Anwendungen verwendet, z. Laptop-Batterien, Kameraobjektive und Hybrid-Autobatterien.
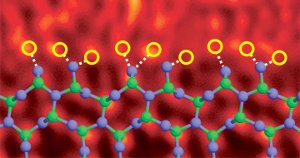
Siliziumnitrid-Korngrenze dotiert mit Lanthanatomen. Bildreferenz (6)
Entdeckung von Lanthan
Lanthan wurde 1839 von Carl G. Mosander im Mineral Cerit in Stockholm, Schweden, entdeckt.
Ceroxid (Ceroxid) wurde bereits 1803 vom schwedischen Chemiker Jacob entdeckt Berzelius im Mineral Cerit. Mosander, der einer von Berzelius Schülern gewesen war, vermutete, dass Ceroxid ein unreines Oxid war, das andere Seltene Erden enthielt. (1) Mosander nahm fein pulverisiertes Cernitrat und fügte kalte verdünnte Salpetersäure hinzu. Ein Teil des in der Säure gelösten Cernitratpulvers, das auf eine neue Erde hinweist, könnte vorhanden sein. Das neue Oxid war basischer als Ceroxid (Ceroxid) und löste sich im Gegensatz zu Ceroxid in der Säure. Mosander trennte die Lösung mit Natriumoxalat und Wärme vom Niederschlag. Er erhielt ein blasses ziegelfarbenes Oxid der neuen Seltenen Erden. (1)
Der Name Lanthana für das neue Oxid wurde von seinem Freund Berzelius vorgeschlagen.
Der Name stammt vom griechischen Wort „Lanthano“ und bedeutet „versteckt“.
Axel Erdmann entdeckte Lanthan im selben Jahr wie Mosander in einem neu gefundenen norwegischen Mineral. Erdmann nannte das neue Mineral Mosandrit zu Ehren von Mosander.(2) Mosander erhielt aus dem Chlorid unreines metallisches Lanthan. (1) Reines Lanthanmetall wurde erstmals 1923 durch Elektrolyse der kondensierten Halogenide von H. Kremers und R. Stevens hergestellt. Mosander studierte weiterhin Lanthana und gab 1841 die Entdeckung bekannt einer anderen darin enthaltenen seltenen Erde. Er nannte es „Didym“, weil es „ein untrennbarer Zwillingsbruder von Lanthan“ zu sein schien. (2)
„Didym“ wurde später in separaten Entdeckungen als eine Mischung unbekannter Seltenerdelemente gezeigt. 1879 entdeckte Lecoq de Boisbaudran das Samarium im Didym und trennte das Samarium davon. Carl Auer von Welsbach entdeckte 1885, dass das verbleibende „Didym“ tatsächlich eine Mischung aus zwei völlig neuen Elementen war: Neodym und Praseodym.


Lanthan wird in einigen Poolprodukten verwendet, um den Gehalt an Phosphatnährstoffen zu reduzieren, die sich ernähren Algen.

Im Uhrzeigersinn von oben in der Mitte: Seltenerdoxide von Praseodym, Cer, Lanthan, Neodym, Samarium und Gadolinium. Foto: LLNL
Aussehen und Eigenschaften
Schädliche Wirkungen:
Lanthan und seine Verbindungen gelten als mäßig giftig.
Eigenschaften:
Lanthan ist ein silberweißes weiches Metall, das mit einem Messer geschnitten werden kann.
Es ist duktil , formbare und freiliegende Oberflächen laufen in Luft, die das Oxid bildet, schnell an. Lanthan reagiert mit Wasser unter Bildung von Lanthanhydroxid plus Wasserstoffgas. Lanthan ist chemisch reaktiv und bildet Verbindungen mit Kohlenstoff, Stickstoff Bor, Selen, Silizium, Phosphor, Schwefel und mit den Halogenen. Lanthan liegt üblicherweise als dreiwertiges Ion, La3 +, in seinen Verbindungen vor.
Verwendung von Lanthan
Lanthan wird in großen Mengen in wiederaufladbaren Nickelmetallhydrid (NiMH) -Batterien für Hybridautos verwendet. Die negative Elektrode (Kathode) in NiMH-Batterien ist eine Mischung aus Metallhydriden, von denen eines typischerweise Lanthanhydrid ist. Das aktive Material an der Kathode ist Wasserstoff, der in der Metallhydridstruktur gespeichert ist. Das Metallhydrid kann je nach Zusammensetzung zwischen 1 Gew .-% und 7 Gew .-% Wasserstoff enthalten. (3) Eine Toyota Prius-Batterie benötigt etwa 10 kg Lanthan. (4)
Lanthan wird als Erdölcrackkatalysator verwendet, der die Aufspaltung langkettiger Kohlenwasserstoffe in kürzerkettige Spezies katalysiert.
Lanthan wird als Additiv zur Herstellung von kugelförmigem Gusseisen und verwendet als Additiv in Stahl.
Flammenfeuerere Feuersteine verwenden Mischmetall (eine Seltenerdlegierung), das Lanthan enthält, um durch Reibung Funken zu erzeugen.
Lanthan wird in Wasserstoffschwammlegierungen verwendet, die das 400-fache ihres Eigenbedarfs haben Volumen von Wasserstoffgas.
Lanthan wird auch zur Herstellung von Nachtsichtbrillen (Infrarot absorbierendes Glas) verwendet.
Hochwertige Kamera- und Teleskoplinsen enthalten Lanthanoxid (La2O3), das verwendet wird Sein hoher Brechungsindex und seine geringe Dispersion.
Lanthancarbonat wird verwendet, um den Phosphatspiegel im Blut bei Patienten mit Nierenerkrankungen zu senken. (5)
Lanthanverbindungen werden auch in einigen Poolprodukten verwendet, um den Gehalt an Phosphatnährstoffen, von denen Algen sich ernähren, zu verringern.
Überfluss und Isotope
Überfluss Erdkruste: 34 Gewichtsteile pro Million, 5 Teile pro Million in Mol
Überfluss Sonnensystem: 2 Teile pro Milliarde pro Gewicht, 0,01 Teile pro Milliarde in Mol
Kosten, rein: 800 USD pro 100 g
Kosten, Volumen: 100 USD pro 100 g
Quelle: Lanthan wird nicht als frei befunden in der Natur. Es kommt hauptsächlich in den Mineralien Monazit und Bastnaesit vor. Kommerziell wird es unter Verwendung verschiedener komplexer Extraktionstechniken aus Monazitsand und Bastnaesit gewonnen. Reines Lanthan wird durch Reduktion des Fluorids mit Calciummetall erhalten.
Isotope: Lanthan hat 31 Isotope, deren Halbwertszeiten bekannt sind, mit Massenzahlen von 119 bis 150. Von diesen ist eines stabil, 139La. Natürlich vorkommendes Lanthan ist eine Mischung der beiden Isotope 138La und 139La mit einer natürlichen Häufigkeit von 0,09% bzw. 99,91%.

Diese Seite zitieren
Für Online-Links kopieren Sie bitte eine der folgenden Seiten und fügen Sie sie ein:
<a href="https://www.chemicool.com/elements/lanthanum.html">Lanthanum</a>
oder
<a href="https://www.chemicool.com/elements/lanthanum.html">Lanthanum Element Facts</a>
Um diese Seite in einem akademischen Dokument zu zitieren, verwenden Sie bitte das folgende MLA-konforme Zitat:
"Lanthanum." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/lanthanum.html>.