Nu a fost identificată o etiologie unică definită a schizofreniei. Majoritatea teoriilor acceptă atât contribuții genetice, cât și de mediu pentru cauzarea schizofreniei cu debut în copilărie (COS).
O revizuire a datelor din Studiul longitudinal al riscului de mediu asupra copiilor britanici că simptomele psihotice din copilărie sunt familiale și ereditare. Aceste simptome sunt asociate cu factori de risc social; tulburări cognitive la vârsta de 5 ani; factorii de risc pentru creșterea locuinței; probleme comportamentale, emoționale și educaționale la vârsta de 5 ani; și condiții comorbide precum auto-vătămarea. Prin urmare, tulburările psihotice din copilărie pot fi un marker al unui proces de dezvoltare afectat.
În plus, comparativ cu debutul obișnuit al schizofreniei la sfârșitul adolescenței sau la vârsta adultă timpurie, apariția schizofreniei cu debut precoce în timpul copilăriei se poate datora creșterii încărcării genetice a schizofreniei sau leziuni precoce ale sistemului nervos central (SNC) datorate unui factor de mediu.
Risc genetic
Mai mulți factori sugerează un risc genetic. Rudele de gradul întâi ale pacienților cu schizofrenie cu debut precoce (EOS) au un risc de 5 până la 20 de ori mai mare de a dezvolta schizofrenie comparativ cu populația generală. Rudele de gradul întâi ale copiilor cu schizofrenie au o rată mai mare de prevalență a schizofreniei și a tulburărilor din spectrul schizofreniei. Un studiu de gemeni din Danemarca a concluzionat că geamănul unui pacient cu schizofrenie avea un risc de 4,7 ori mai mare de a dezvolta ei înșiși schizofrenie dacă primul gemeni a fost diagnosticat sau prezentat cu boală înainte de 22 de ani. Ei nu au studiat mai multe categorii de vârstă sub 22 de ani, dar au spus (pe baza diviziunilor lor de vârstă peste 22 de ani) că scăderea generală a vârstei la primul diagnostic a crescut semnificativ riscul diagnosticului cu doi gemeni.
În studiul cu risc ridicat din Pittsburgh, constatările în rândul tinerilor rude ale pacienților cu schizofrenie au inclus următoarele:
-
Ridicat proporțiile psihopatologiei axei I, în special tulburarea de hiperactivitate cu deficit de atenție (ADHD) și tulburarea de conduită
-
Creșterea emoției exprimate în rândul rudelor
-
O tendință pentru mai multă psihopatologie la descendenții rudelor cu emoție ridicată
-
Atenție afectată , memorie spațială de lucru și funcții executive
-
Semne neurologice moi crescute
-
Reduceri de volum în amigdala, hipocampus și girusul temporal superior
-
Diminuarea somnului cu unde lente
Rudele de gradul I ale indivizilor cu schizofrenie au afectarea mișcărilor de urmărire lină oculară similare cu cele constatate la examinarea pacienților a schizofrenie. Un studiu a constatat că frații sănătoși ai pacienților cu COS au scăzut substanța cenușie cerebrală în același model cu cel observat la pacienți.
Examinarea pacienților Institutului Național de Sănătate Mentală cu debut de schizofrenie înainte de vârsta de 13 ani a relevat o rată de 10% a anomaliilor citogenetice. Anumite mutații ale genomului au fost, de asemenea, semnificativ legate de EOS, inclusiv sindromul de deleție 1q21.1, 15q13.3 și 22q11.2 și ar putea reprezenta 0,5% -1% din cazuri. În plus, asociațiile cu mai multe gene de susceptibilitate la schizofrenie în cohorte de pacienți adulți au fost reproduse la pacienții cu schizofrenie cu debut în copilărie, inclusiv DAOA, NRG1, DTNBP1 și GAD1. Un studiu efectuat pe pacienți chinezi han a descoperit că gena rs139887 în SOX10 este asociată cu bărbații cu schizofrenie cu debut precoce. Un studiu diferit pe 385 de pacienți chinezi han a descoperit un polimorfism specific în receptorul serotoninei 2A pentru a „conferi susceptibilitate la schizofrenie odată cu debutul în vârstă timpurie”. Variațiile genetice rare ale miARN (implicate în dezvoltarea creierului) s-au dovedit a fi cu 50% mai frecvente la pacienții cu schizofrenie cu debut precoce decât la populația martor. A existat, de asemenea, un exces de noi variante ale numărului de copii care s-au suprapus sau au perturbat genele cunoscute la pacienți în comparație cu cromozomii „control” parental netransmis. Un studiu de caz publicat în Boston a dezvăluit doi pacienți care au dezvoltat schizofrenie înainte de vârsta de 7 ani, care au ambele variante ale numărului de copii la 16p13.11, un loc asociat atât cu schizofrenia cu debut la adulți, cât și cu tulburarea spectrului autist.
Un studiu realizat pe 177 de pacienți din Suedia a constatat o hipometilare globală a ADN-ului mai mare (care transmite instabilitate genetică) la leucocitele pacienților cu schizofrenie în comparație cu martorii, această constatare fiind și mai pronunțată la pacienții cu schizofrenie cu debut precoce. {ref204-REFERINȚĂ INVALIDĂ} Sunt în curs studii pentru a investiga corelația metilării ADN și diferențele de gen în schizofrenia cu debut precoce.
Anomaliile neurodezvoltării și neuroanatomice
Mai multe studii au descris complicații în timpul sarcinii și nașterii la adulți care ulterior dezvoltă schizofrenie. Combinația dintre riscul genetic și dovezi ale deteriorării dobândite a sugerat o teorie a neurodezvoltării cu anomalii precoce ale SNC care contribuie la o vulnerabilitate crescută la schizofrenie mai târziu în viață. O creștere a caracteristicilor dismorfice minore a sugerat probleme de debut prenatal. S-a demonstrat că o creștere a complicațiilor asociate hipoxiei crește șansele de dezvoltare a schizofreniei cu debut mai devreme.
Neuroanatomia persoanelor cu COS a fost examinată prin neuroimagistică. La fel ca la adulții cu schizofrenie, cea mai consistentă constatare a fost mărirea ventriculilor laterali. Deși statice la adulți, anomaliile morfologiei creierului evoluează în timpul adolescenței. Posibilitatea unui proces neurodegenerativ a fost ridicată, dar și pusă la îndoială.
Literatura a dezvăluit o poveste convingătoare pentru deficitele de substanță gri la indivizii cu COS. Mai exact, Rapoport și colab. au demonstrat că adolescenții cu schizofrenie au scăderi semnificativ mai mari ale substanței gri frontale și temporale volume decât cele observate la controalele sănătoase potrivite pentru vârstă (vezi imaginile de mai jos). Anchetatorii au descoperit în plus că copiii cu schizofrenie au mai multe pierderi de substanță cenușie corticală decât copiii cu psihoză tranzitorie.
Greenstein și colab. a raportat că pierderea grosimii corticale în schizofrenia cu debut în copilărie pare să se localizeze odată cu vârsta către regiunile prefrontale și temporale care se observă la pacienții cu schizofrenie cu debut la adulți, indiferent de medicamente. Un alt studiu a arătat că pacienții cu schizofrenie cu debut în copilărie care îndeplineau criteriile de remisie aveau substanță cenușie mai groasă în cortexurile prefrontale, temporale și parietale în comparație cu pacienții neremisiți, sugerând o posibilă relație a plasticității creierului cu prognosticul.
Studiul cu risc ridicat de la Edinburgh a sugerat că la subiecții cu risc crescut (definiți ca subiecți care aveau cel puțin 2 rude apropiate cu schizofrenie) schimbarea de la vulnerabilitate la psihoză poate fi precedată prin reducerea dimensiunii și funcționarea deteriorării lobului temporal.
Într-o revizuire sistematică și meta-analiză a 66 de lucrări care compară volumul creierului la pacienții cu un prim episod psihotic cu volum în controale sănătoase, meta-analiza a sugerat că întregul creier și volumul hipocampic este redus și volumul ventricular este crescut la pacienții afectați în raport cu controalele sănătoase. Mai mult, scanările prin rezonanță magnetică cerebrală obținute la subiecții cu schizofrenie la debutul copilăriei, frații lor nepsihotici și subiecții de comparație a sănătății cu vârste cuprinse între 10 și 29 de ani care au măsurat volumul total, stâng și drept al hipocampului au arătat că pacienții cu debut în copilărie schizofrenia a avut o reducere fixă a volumelor de hipocamp în comparație cu frații nepsihotici și subiecții cu comparație de sănătate. În plus, nu s-au observat diferențe volumetrice sau de traiectorie semnificative între frații nepsihotici și subiecții de comparație sănătoși. Prin urmare, scăderea volumului hipocampic poate reprezenta un fenotip al bolii intermediare.
Un studiu efectuat pe frați de pacienți cu schizofrenie cu debut în copilărie a găsit o asociere între diferențele volumetrice ale girusului frontal superior drept și cerebel și performanța de învățare târzie cu privire la sarcina de predicție a vremii ( un test de învățare a abilităților cognitive). Autorii au sugerat că unele dintre aceste anomalii volumetrice pot fi „endofenotipul potențial pentru schizofrenie”. Ei au sugerat că riscul genetic a fost „cel mai evident în adolescență”, deoarece aceste anomalii s-au normalizat pe măsură ce frații au ajuns la maturitate.
Studiile efectuate la frații nonpsihotici ai pacienților cu schizofrenie cu debut în copilărie au arătat un model de deficite de materie cenușie prefrontală și temporală în vârstele timpurii care par să se normalizeze până când subiecții ajung la adolescența târzie . Aceste rezultate au fost replicate de Mattai și colab., Care au arătat, de asemenea, că frații nonpsihotici ai pacienților cu schizofrenie cu debut în copilărie au deficite timpurii de substanță cenușie care se îmbunătățesc în timp, sugerând că adolescența târzie poate fi un moment critic pentru cea mai mare localizare a deficitelor în probands sau normalizarea în frați nonpsihotici.
Un studiu privind volumul și forma striatală a comparat pacienții cu schizofrenie cu debut în copilărie, frații lor și controalele sănătoase. Au descoperit că pacienții cu schizofrenie cu debut în copilărie au prezentat „diferențe de formă striatală subregională”, în special deplasarea spre interior a porțiunii anterioare a capului striatal și deplasarea spre exterior la porțiunea posterioară a capului striatal. Frații acestor pacienți au prezentat cel puțin parțial aceste variații de formă. .Aceste descoperiri prezintă un interes deosebit, deoarece „tractele de la capul striatal se extind pe scară largă până la cortexul prefrontal”, care arată deficite de grosime corticală la pacienții cu schizofrenie la debutul copilăriei.
Studii de conectivitatea substanței albe în schizofrenia cu debut în copilărie a găsit anomalii în cuneul stâng și drept (lobul occipital, cortexul vizual) atât la pacienții cu schizofrenie cu debut în copilărie, cât și la frații lor, deși nu au putut găsi o corelație semnificativă statistic între aceste anomalii și severitatea simptomelor clinice. Un alt studiu al anomaliilor substanței albe a propus anomalii ale fasciculului longitudinal inferior stâng și ale fasciculului fronto-occipital inferior stâng ca „posibili biomarkeri ai vulnerabilității pentru dezvoltarea schizofreniei”. Un alt studiu a observat deficite de creștere a substanței albe la frații non-psihotici ai pacienților cu schizofrenie cu debut în copilărie, dar aceste deficite s-au normalizat odată cu vârsta.
Un studiu care analizează datele RMN a întrebat dacă maturarea corticală anormală a fost limitată la modulele de dezvoltare din creier. Au descoperit că pacienții cu schizofrenie cu debut în copilărie aveau „traiectorii de maturare modificate ale zonelor corticale” implicați în modulul de dezvoltare cingulo-fronto-temporală.
Un studiu a găsit pacienți cu debut în copilărie schizofrenia afișează „maturarea întârziată a conectivității occipitotemporale, cu frații neafectați care prezintă un fenotip mai blând”. Această întârziere s-a normalizat la frații neafectați până la jumătatea adolescenței și s-a normalizat la pacienții cu schizofrenie cu debut în copilărie până la vârsta adultă timpurie. Conectivitatea occipitotemporală este asociată cu fasciculul longitudinal inferior, în care întârzierile de dezvoltare pot fi asociate cu halucinații.
Pacienții diagnosticați cu schizofrenie cu debut în copilărie s-au dovedit a avea o rezistență redusă a conectivității funcționale pe distanțe scurte, deși „distanțele anatomice mai lungi erau relativ normale în grupul COS”. Autorii acestui studiu au constatat că acest lucru este în concordanță cu ideea de „supratundere” a conexiunilor pe distanțe scurte ”în schizofrenia cu debut în copilărie.
La studierea rețelelor de memorie de lucru, s-a constatat că pacienții diagnosticați cu schizofrenie cu debut precoce au prezentat un model anormal similar al conectivității cortexului prefrontal dorsolateral ca adulții diagnosticați cu schizofrenie.
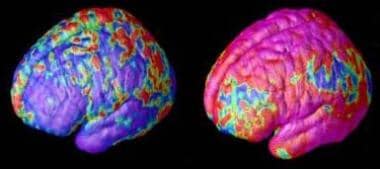 Schizofrenia copilăriei. Deficite de substanță cenușie timpurie și târzie în schizofrenie. Zonele de pierdere a substanței cenușii, prezentate în roșu și galben, se răspândesc de la spate în față (de la dreapta la stânga) timp de 5 ani în datele de scanare RMN compozite de la 12 adolescenți cu schizofrenie la debutul copilăriei, începând cu vârsta de 14 ani (stânga). Roșu și galben denotă zone cu pierderi mai mari. Sursa: Paul Thompson, MD, UCLA, Laboratorul de Neuroimagistică. Fișier media NIMH.
Schizofrenia copilăriei. Deficite de substanță cenușie timpurie și târzie în schizofrenie. Zonele de pierdere a substanței cenușii, prezentate în roșu și galben, se răspândesc de la spate în față (de la dreapta la stânga) timp de 5 ani în datele de scanare RMN compozite de la 12 adolescenți cu schizofrenie la debutul copilăriei, începând cu vârsta de 14 ani (stânga). Roșu și galben denotă zone cu pierderi mai mari. Sursa: Paul Thompson, MD, UCLA, Laboratorul de Neuroimagistică. Fișier media NIMH. 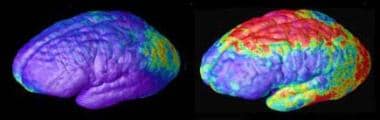 Schizofrenia copilăriei. Rata pierderii substanței cenușii. Datele de scanare RMN compozite care arată zone cu pierderi de substanță cenușie pe parcursul a 5 ani, comparând 12 adolescenți normali (stânga) și 12 adolescenți cu schizofrenie la debutul copilăriei. Roșu și galben denotă zone cu pierderi mai mari. Fața creierului este la stânga. Sursa: Paul Thompson, MD, UCLA, Laboratorul de Neuroimagistică. Fișier media NIMH.
Schizofrenia copilăriei. Rata pierderii substanței cenușii. Datele de scanare RMN compozite care arată zone cu pierderi de substanță cenușie pe parcursul a 5 ani, comparând 12 adolescenți normali (stânga) și 12 adolescenți cu schizofrenie la debutul copilăriei. Roșu și galben denotă zone cu pierderi mai mari. Fața creierului este la stânga. Sursa: Paul Thompson, MD, UCLA, Laboratorul de Neuroimagistică. Fișier media NIMH. Consumul de canabis
Dovezile din 6 studii longitudinale din 5 țări au arătat că consumul regulat de canabis prezice un risc crescut de schizofrenie diagnostic sau de raportare a simptomelor psihozei.
Un studiu a constatat că 74% dintre subiecții cu tulburări de consum de canabis au avut debutul tulburării de consum de canabis înainte de apariția simptomelor psihotice pozitive. Acești subiecți erau predominant bărbați, mai tineri la intrarea în studiu, aveau o vârstă mai timpurie la apariția simptomelor pozitive, un nivel de educație mai redus, un statut auto-socioeconomic mai scăzut, o ajustare socială mai bună a copilului premorbidă, o tendință de ajustare academică a copilului premorbidă mai slabă, mai puține anomalii motorii , dar halucinații și amăgiri mai severe.
Cu toate acestea, în analiza multivariată, doar sexul masculin, starea socioeconomică mai slabă, ajustarea socială premorbidă mai bună și simptome pozitive mai severe la intrarea în studiu au fost asociate cu o istorie de tulburări de consum de canabis pe tot parcursul vieții. Autorii au concluzionat că, deși consumul de canabis precede debutul bolii la majoritatea pacienților, nu a existat nicio asociere semnificativă între debutul bolii și tulburările consumului de canabis care nu au fost explicate de variabilele demografice și clinice.
Cu toate acestea, un alt studiu a folosit Programul pentru tulburări afective și schizofrenia copiilor de vârstă școlară (K-SADS) pentru a evalua o posibilă asociere între consumul de canabis, evenimente traumatice și simptome psihotice în adolescență. Consumul de canabis și traumele copilăriei au fost semnificativ asociate cu riscul de a experimenta simptome psihotice.Atunci când consumul de canabis și traumele din copilărie au apărut în cadrul aceluiași pacient, riscul de simptome psihotice a crescut dincolo de riscul pe care îl prezintă singurul factor. Cu toate acestea, doar 14 participanți la studiu au raportat că se confruntă cu simptome psihotice. Prin urmare, aceste constatări trebuie reproduse.
Un studiu din 2012 a obținut RMN ponderate T1 de la adolescenți cu schizofrenie cu debut precoce (EOS), tulburări de consum de canabis (CUD), EOS plus CUD și controale sănătoase. În grupul EOS și grupul CUD, regiunea parietală superioară stângă a avut volume mai mici de substanță cenușie în comparație cu controalele sănătoase. Grupul combinat EOS / CUD a prezentat rezultate similare, dar nu s-a găsit niciun efect aditiv. Cu toate acestea, grupul combinat EOS / CUD a avut volume mai mici de substanță cenușie în talamusul stâng în comparație cu CUD și grupurile de control sănătoase.
Consumul de canabis la începutul adolescenților, împreună cu o vulnerabilitate genetică specifică, poate fi un factor de risc pentru dezvoltarea schizofreniei.
Revizuirea literaturii din 2015 a concluzionat că „canabisul modifică cursul psihozei prin declanșarea debutului precoce al bolii la o populație de tineri vulnerabili”. Deși au fost observate mai multe teorii cu privire la modul în care acest lucru s-ar putea întâmpla – abuzul de substanțe care influențează tulburările psihiatrice, tulburările psihiatrice care influențează abuzul de substanțe, procese independente și reciproc excludente – s-au abținut de la atribuirea unui anumit mecanism.
Traumatismul timpuriu al copilăriei
După cum sa menționat anterior, traumatismul timpuriu al copilăriei a fost corelat cu simptomele psihotice ale copilăriei. Un studiu a constatat că 93,1% dintre pacienții cu schizofrenie cu debut precoce „au prezentat evenimente adverse de viață în timpul copilăriei”. 46,9% au „experimentat evenimente traumatice”.
În mod specific, Arsenault și colab. au obținut date din studiul longitudinal Twin Risk longitudinal, care a intervievat mamele când copiii lor aveau vârsta de 5, 7, 10 și 12 ani, dacă copiii au suferit maltratare de către un adult, hărțuire de către colegi sau implicare într-un accident. Când copiii aveau vârsta de 12 ani, au fost întrebați despre experiențe de hărțuire și simptome psihotice. Copiii care au suferit maltratare de către un adult sau hărțuire de către colegi au fost mai probabil pentru a raporta simptome psihotice la vârsta de 12 ani decât copiii care nu au prezentat maltratare. Constatarea unui risc mai mare de tulburări psihotice a fost observată indiferent dacă aceste evenimente au apărut la începutul vieții sau mai târziu în copilărie. În plus, această constatare a rămas semnificativă atunci când sexul, socioeconomic privarea, internalizarea sau externalizarea problemelor, răspunderea genetică a copiilor la dezvoltarea psihozei și coeficientul de inteligență au fost controlate.
În plus, un studiu prospectiv de cohortă o f Copiii de 12 ani au evaluat riscul apariției simptomelor psihotice utilizând interviul cu simptome asemănătoare psihozei. Copiii care au fost victime ale hărțuirii la vârsta de 8 și / sau 10 ani, independent de psihopatologia anterioară, de adversitatea familiei sau de IQ-ul copilului, au avut o creștere de 2 ori a riscului de simptome psihotice. Riscul a crescut atunci când victimizarea a fost cronică sau severă.
Infecții
Un studiu a găsit, de asemenea, o legătură între infecțiile virale ale SNC și psihozele ulterioare. Mai exact, o cohortă națională de copii născuți între 1973-1985 a fost urmată de utilizarea registrelor naționale suedeze pentru a determina asocierea dintre infecțiile SNC la vârsta de 0-12 ani și admiterile pentru boli psihotice neafective de la 14 ani (N = 2269). A existat un risc ușor crescut de boli psihotice neafective asociate cu infecții virale ale SNC, precum și cu schizofrenie. Nu a existat un risc crescut în raport cu infecțiile bacteriene. Expunerea la virusul oreionului sau citomegalovirusului a fost asociată cu psihoze ulterioare. Cu toate acestea, sunt necesare cercetări suplimentare în legătură cu această corelație.
Imunologie
Unii își concentrează atenția asupra markerilor imunologici ca potențiali biomarkeri ai schizofreniei, unii chiar lucrând pentru găsirea o relație de cauzalitate între procesele imune și schizofrenia. Un astfel de studiu a implicat o componentă autoimună a schizofreniei, menționând autoanticorpii asociați cu trombocite (PAA) care trebuie crescută la pacienții cu schizofrenie cu debut în copilărie comparativ cu un grup de copii diagnosticați cu tulburări de conduită. Autorii acestui studiu au sugerat măsurarea PAA ca un posibil biomarker diagnostic al schizofreniei cu debut în copilărie. Un alt studiu a constatat o corelație semnificativă statistic între simptomele negative ale schizofreniei cu debut precoce și nivelurile de IL-4 și IL-10.
Neurotransmițători și schizofrenie
Majoritatea studiilor psihologice, farmacologice și de neuroimagistică a schizofreniei cu debut în copilărie au sugerat disfuncții în cortexul prefrontal și sistemul limbic. Neurotransmițătorul implicat în fiziopatologia schizofreniei este dopamina.Medicamentele care cresc activitatea dopaminergică pot induce o psihoză schizofreniformă, iar medicamentele care blochează receptorii postinaptici D2 ajută la ameliorarea simptomelor schizofreniei.
Alte neurotransmițători pot fi, de asemenea, implicați în fiziopatologia schizofreniei. Glutamatul a fost implicat pe baza, parțial, pe producerea de simptome psihotice de către fenciclidină și prezența disfuncției receptorului N-metil-D-aspartat (NMDA). Serotonina poate fi importantă. Noile medicamente antipsihotice atipice au efecte serotoninergice proeminente. Studiile preliminare sugerează că acidul gamma-aminobutiric (GABA) poate fi important. N-acetilaspartatul poate juca și un rol, întrucât un studiu a constatat niveluri mai scăzute în cortexul prefrontal și în talamus la pacienții cu schizofrenie cu debut precoce. Aceste niveluri au răspuns și s-au normalizat după șase luni de tratament cu antipsihotice atipice.
Diverse etiologii potențiale
Nicio singură etiologie nu a fost identificată pentru schizofrenia cu debut în copilărie și probabil că este multifactorială. Ca atare, mulți încearcă să identifice potențiale cauze, factori care contribuie sau biomarkeri legați de schizofrenia cu debut în copilărie. cu debutul în copilărie versus debutul psihozei cu adolescenți au fost mai predispuși să aibă mame bolnave în timpul sarcinii sau copilăriei. Autorii au sugerat că boala maternă poate fi o componentă relevantă a schizofreniei cu debut în copilărie. Un alt studiu a examinat o posibilă legătură între schizofrenia cu debut precoce și cancerul pulmonar cu celule mici materne. Acei autori au suspectat o conexiune din cauza aspectului potențial prodromal al naturii autoimune a cancerului pulmonar cu celule mici. Mărimea eșantionului lor a fost mică, dar au găsit o asociere semnificativă statistic între cele două.
Un alt studiu a analizat efectul stresului oxidativ în patogeneza schizofreniei. Autorii studiului au descoperit că starea antioxidantă totală a fost asociată semnificativ cu funcția cognitivă de bază în psihoza cu debut precoce (starea totală de antioxidant scăzută fiind asociată cu o performanță cognitivă mai mică.)