Elementul chimic lantan este clasificat drept lantanid și metal de pământuri rare. A fost descoperit în 1839 de Carl G. Mosander.

Zona de date
| Clasificare: | Lantanul este o lantanidă și un pământ rar |
| Culoare: | alb-argintiu |
| Atomic greutate: | 138.9055 |
| Stare: | solid |
| Punct de topire : | 1540 oC, 1813,2 K |
| Punct de fierbere: | 2830 oC, 3103 K |
| Electroni: | 57 |
| Protoni: | 57 |
| Neutronii din izotopul cel mai abundent: | 82 |
| Cochilii de electroni: | 2,8,18,18, 9,2 |
| Configurare electronică: | 5d1 6s2 |
| Densitate @ 20oC: | 6,16 g / cm3 |
Afișați mai multe, inclusiv: încălziri, energii, oxidare, reacții
, Compuși, Raze, Conductivități
| Volumul atomic: | 22,5 cm3 / mol |
| Structură: | hcp: hexagonal închis |
| Duritate: | 2,5 mo |
| Capacitate termică specifică | 0,19 J g-1 K-1 |
| Căldură de fuziune | 6,20 kJ mol-1 |
| Căldură de atomizare | 414 kJ mol-1 |
| Căldură de vaporizare | 400 kJ mol-1 |
| Prima energie de ionizare | 538,1 kJ mol-1 |
| A doua energie de ionizare | 1067 kJ mol-1 |
| A treia energie de ionizare | 1850 kJ mol-1 |
| Afinitate electronică | 50 kJ mol-1 |
| Număr minim de oxidare | 0 |
| Min. nr. obișnuit de oxidare. | 0 |
| Numărul maxim de oxidare | 3 |
| Max. oxidare comună nr. | 3 |
| Electronegativitate (Pauling Scale) | 1.1 |
| Polarizabilitate volum | 31,1 Å3 |
| Reacție cu aer | viguros, w / ht ⇒ La2O3 |
| Reacție cu 15 M HNO3 | ușoară, ⇒ La (NO3) 3 |
| Reacție cu 6 M HCl | ușoară, ⇒ H2, LaCl3 |
| Reacție cu NaOH 6 M | niciunul |
| Oxid ( s) | La2O3 |
| Hidrură (e) | LaH2, LaH3 |
| Cloruri | LaCl3 |
| Raza atomică | 195 pm |
| Raza ionică (1+ ion) | – |
| Raza ionică (2+ ion) | – |
| Raza ionică (3+ ion) | 117.2 pm |
| Raza ionică (1- ion) | – |
| Raza ionică (2- ion) | – |
| Ionic raza (3- ion) | – |
| Conductivitate termică | 13,4 W m-1 K-1 |
| Conductivitate electrică | 1,9 x 106 S m-1 |
| Punct de îngheț / topire: | 1540 oC, 1813,2 K |

Lantanul este utilizat în multe aplicații, cum ar fi iluminatul de studio, baterii pentru laptopuri, obiective pentru camere și baterii pentru mașini hibride.
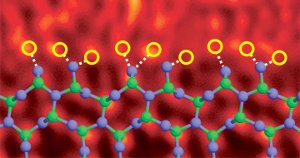
Limita granulelor de nitrură de siliciu cu atomi de lantan. Ref. Imagine (6)
Descoperirea Lantanului
Lantanul a fost descoperit în 1839 de Carl G. Mosander în ceritul mineral din Stockholm, Suedia.
Ceria (oxid de ceriu) fusese deja descoperit în 1803 de chimistul suedez Jacob Berzelius în ceritul mineral. Mosander, care fusese unul dintre studenții lui Berzelius, bănuia că ceria este un oxid impur care conține alte pământuri rare. (1)
Mosander a luat azotat de ceriu sub formă de pulbere fină și a adăugat acid azotic diluat la rece. O parte din pulberea de azotat de ceriu dizolvată în acid indicând un pământ nou ar putea fi prezentă. Noul oxid a fost mai bazic decât ceria (oxid de ceriu) și, spre deosebire de ceria, s-a dizolvat în acid.
Mosander a separat soluția de precipitat folosind oxalat de sodiu și căldură. A obținut un oxid de cărămidă palidă din noul pământ rar. (1)
Numele lanthana pentru noul oxid a fost sugerat de prietenul său Berzelius.
Numele provine din cuvântul grecesc „lanthano” care înseamnă a fi ascuns.
Axel Erdmann a descoperit lantanul independent în același an ca Mosander într-un mineral norvegian nou găsit. Erdmann a numit noul mineral mosandrit, în cinstea lui Mosander.(2)
Mosander a obținut lantan metalic impur din clorură. (1)
Lantanul pur metalic a fost produs pentru prima dată în 1923 prin electroliza halogenurilor topite de H. Kremers și R. Stevens.
Mosander a continuat studierea lanthanei și în 1841 a anunțat descoperirea a unui alt pământ rar conținut în el. El l-a numit „didymium” pentru că părea a fi „un frate gemeni inseparabil al lantanului.” (2)
„Didymium” a fost arătat mai târziu în descoperiri separate ca fiind un amestec de elemente necunoscute din pământul rar. În 1879 Lecoq de Boisbaudran a detectat samariul în didimiu și a separat samariul de acesta. Carl Auer von Welsbach a descoperit în 1885 că „didimiul” rămas era de fapt un amestec de două elemente complet noi: neodim și praseodim.


Lantanul este utilizat în unele produse pentru piscină pentru a reduce nivelul de substanțe nutritive fosfat care se hrănesc alge.

În sensul acelor de ceasornic de la centrul superior: oxizi de pământ rar de praseodim, ceriu, lantan, neodim, samariu și gadoliniu. Foto: LLNL
Aspect și caracteristici
Efecte nocive:
Lantan și compușii săi sunt considerate a fi moderat toxice.
Caracteristici:
Lantanul este un metal moale alb-argintiu, care poate fi tăiat cu un cuțit.
Este ductil , suprafețele maleabile și expuse se ternesc rapid în aer formând oxidul.
Lantanul reacționează cu apa pentru a forma hidroxid de lantan plus hidrogen gazos.
Lantanul este chimic reactiv și formează compuși cu carbon, azot , bor, seleniu, siliciu, fosfor, sulf și cu halogeni.
Lantanul există de obicei ca ion trivalent, La3 +, în compușii săi.
Utilizările lantanului
Lantanul este utilizat în cantități mari în bateriile reîncărcabile de hidrură de nichel metalic (NiMH) pentru automobile hibride. Electrodul negativ (catodul) din bateriile NiMH este un amestec de hidruri metalice – dintre care una este de obicei hidrura de lantan. Materialul activ de la catod este hidrogen, care este stocat în structura metalică de hidrură. Hidrura metalică poate, în funcție de compoziția sa, să dețină între 1% și 7% hidrogen în greutate. (3) O baterie Toyota Prius necesită aproximativ 10 kg de lantan. (4)
Lantanul este utilizat ca catalizator de cracare a petrolului, catalizând divizarea hidrocarburilor cu lanț lung în specii cu lanț mai scurt.
Lantanul este utilizat ca aditiv pentru a produce fonta nodulară și ca aditiv în oțel.
Silexurile cu brichetă utilizează metal mixt (un aliaj de pământ rar) care conține lantan pentru a produce scântei prin frecare.
Lantanul este utilizat în aliajele cu burete de hidrogen, care iau de până la 400 de ori volumul de hidrogen gazos.
Lantanul este, de asemenea, utilizat pentru a face ochelari de vedere nocturnă (sticlă absorbantă cu infraroșu).
Obiectivele de înaltă calitate ale camerelor și ale telescopului conțin oxid de lantan (La2O3) folosind indicele său de refracție ridicat și dispersia redusă.
Carbonatul de lantan este utilizat pentru a reduce nivelurile de fosfat din sânge la pacienții cu afecțiuni renale. (5)
Compușii de lantan sunt, de asemenea, utilizați în unele produse pentru piscină pentru a reduce nivelul de substanțe nutritive fosfatice din care se hrănesc algele.
Abundență și izotopi
Abundența scoarței terestre: 34 părți pe milion în greutate, 5 părți pe milion în aluni
Abundența sistemului solar: 2 părți pe miliard în greutate, 0,01 părți pe miliard de moli
Cost, pur: 800 $ pe 100g
Cost, vrac: $ pe 100g
Sursă: Lantanul nu este găsit gratuit în natură. Se găsește în principal în mineralele monazit și bastnaesit. Din punct de vedere comercial, este recuperat din nisip monazit și bastnaesit folosind diverse tehnici complexe de extracție. Lantanul pur se obține prin reducerea fluorului cu calciu metalic.
Izotopi: Lantanul are 31 de izotopi ale căror perioade de înjumătățire sunt cunoscute, cu numere de masă de la 119 la 150. Dintre acestea, unul este stabil, 139La. Lantanul natural este un amestec dintre cei doi izotopi 138La și 139La cu abundențe naturale de 0,09% și respectiv 99,91%.

Citați această pagină
Pentru conectarea online, copiați și inserați unul dintre următoarele:
<a href="https://www.chemicool.com/elements/lanthanum.html">Lanthanum</a>
sau
<a href="https://www.chemicool.com/elements/lanthanum.html">Lanthanum Element Facts</a>
Pentru a cita această pagină într-un document academic, vă rugăm să utilizați următoarea citare conformă MLA:
"Lanthanum." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/lanthanum.html>.