氷は水よりも密度が低いため、浮きます。水は1.0gm /立方体cmの密度を持っています。
氷の密度Ihは0.931gm /立方体cmです。
しかし、両方を作った場合、なぜ氷は水よりも密度が低くなります。 H2Oの分子のアップ?
————– >スピンオン——– >-スピンオフ
—— >スペースフィル/ cpk ——– >スティック—- >ボールアンドスティック
分子を回転させる— >左クリックしてドラッグ
ズームするには-> >左クリックしてShiftキーを押したままにしますボタンを押して垂直方向にドラッグ
Jsmolメニュー— > >右クリック
これを試して!!
最初にワイヤーフレームに変更します:
ボックス上でマウスの右ボタンをクリックします
スタイル->スキーム- ->ワイヤーフレーム
ラベルアトム:
スタイル->ラベル— >原子番号
次の角度を測定します:
< 415
< 512
< 213
< 314
角度を測定するには:原子の上でマウスの左下を押したまま、原子1をダブルクリックし、2番目の原子(中心原子)にドラッグします。中心原子をシングルクリックし、原子3をドラッグしてダブルクリックします。
—— >スペースフィル/ cpk ——– >スティック—- >ボールアンドスティック
液体の水は部分的に秩序化された構造をしており、水素結合が絶えず形成されています。崩壊します。
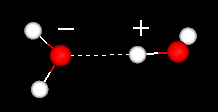
一方、氷は堅い格子構造を持っています。
液体の水では、各分子は約3.4の他の水分子に水素結合しています。
氷では、各分子は他の4つの分子に水素結合しています。
以下の2つの構造を比較してください。氷の構造内の空きスペースに注意してください。
 |
 |
氷Ihでは、各水が形成されます最も近い隣接する酸素まで2.76オングストロームのO — O距離を持つ4つの水素結合。氷の秩序だった構造のため、与えられた体積空間にあるH20分子は少なくなります。
これを試してください-
これを試してください-
1)測定上記の構造に示されている氷中の隣接する2つの酸素原子間のOO距離。
提供されたスペースに回答を入力してください。
氷とは異なり、室温の水は絶えず動いています。水素結合は絶えず形成され、壊れています。ここをクリックして、動いている水分子を確認してください。