化学元素ランタンは、ランタニドと希土類金属に分類されます。 1839年にCarlG.Mosanderによって発見されました。

データゾーン
| 分類: | ランタナムはランタニドと希土類の金属です |
| 色: | 銀白色 |
| 原子重量: | 138.9055 |
| 状態: | 固体 |
| 融点: | 1540 oC、1813.2 K |
| 沸点: | 2830 oC、3103 K |
| 電子: | 57 |
| プロトン: | 57 |
| 最も豊富な同位体の中性子: | 82 |
| 電子シェル: | 2,8,18,18、 9,2 |
| 電子構成: | 5d1 6s2 |
| 密度@ 20oC: | 6.16 g / cm3 |
熱、エネルギー、酸化、
反応などの詳細を表示、化合物、半径、導電率
| 原子体積: | 22.5 cm3 / mol |
| 構造: | hcp:六角形の最密充填 |
| 硬度: | 2.5モル |
| 比熱容量 | 0.19 J g-1 K-1 |
| 溶融熱 | 6.20 kJ mol-1 |
| 噴霧の熱 | 414 kJ mol-1 |
| 熱気化 | 400 kJ mol-1 |
| 最初のイオン化エネルギー | 538.1 kJ mol-1 |
| 2番目のイオン化エネルギー | 1067 kJ mol-1 |
| 3番目のイオン化エネルギー | 1850 kJ mol-1 |
| 電子親和性 | 50 kJ mol-1 |
| 最小酸化数 | 0 |
| 最小一般的な酸化番号 | 0 |
| 最大酸化数 | 3 |
| 最大一般的な酸化番号 | 3 |
| 電気陰性度(ポーリングスケール) | 1.1 |
| 分極性体積 | 31.1Å3 |
| 空気との反応 | 活発、w /ht⇒La2O3 |
| 15 MHNO3との反応 | 穏やか、⇒La(NO3)3 |
| 6 MHClとの反応 | マイルド、⇒H2、LaCl3 |
| 6 MNaOHとの反応 | なし |
| 酸化物( s) | La2O3 |
| 水素化物 | LaH2、LaH3 |
| 塩化物 | LaCl3 |
| 原子半径 | 195 pm |
| イオン半径(1+イオン) | – |
| イオン半径(2+イオン) | – |
| イオン半径(3+イオン) | 117.2 pm |
| イオン半径(1-イオン) | – |
| イオン半径(2イオン) | – |
| イオン半径(3-イオン) | – |
| 熱伝導率 | 13.4 W m-1 K-1 |
| 電気伝導率 | 1.9 x 106 S m-1 |
| 凝固点/融点: | 1540 oC、1813.2 K |

ランタンは、スタジオの照明など、多くのアプリケーションで使用されています。ラップトップバッテリー、カメラレンズ、ハイブリッドカーバッテリー。
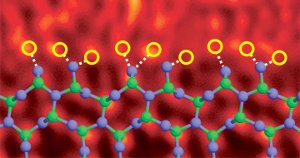
窒化ケイ素粒界ドープランタン原子で。画像参照。 (6)
ランタンの発見
ランタナムは1839年にカール・G・モサンダーによってスウェーデンのストックホルムの鉱物セル石で発見されました。
セリア(酸化セリウム)は1803年にスウェーデンの化学者ジェイコブによってすでに発見されていました。ミネラルセライトのベルセリウス。ベルセリウスの学生の一人であったモザンダーは、セリアが他の希土類を含む不純な酸化物であると疑っていました。 (1)
モザンダーは、微粉末の硝酸セリウムを取り、冷希硝酸を加えました。酸に溶解した硝酸セリウム粉末の一部は、新しい地球が存在する可能性があることを示しています。新しい酸化物はセリア(酸化セリウム)よりも塩基性であり、セリアとは異なり、酸に溶解していました。
モザンダーは、シュウ酸ナトリウムと熱を使用して沈殿物から溶液を分離しました。彼は新しい希土類の淡いレンガ色の酸化物を手に入れました。 (1)
新しい酸化物のランタンという名前は、友人のベルセリウスによって提案されました。
この名前は、隠されることを意味するギリシャ語の「ランタン」に由来しています。
アクセル・エルトマンは、モサンダーと同じ年に、新たに発見されたノルウェーの鉱物からランタンを独自に発見しました。エルドマンは、モザンダーに敬意を表して、新しい鉱物モサンドライトを呼びました。(2)
モザンダーは、塩化物から不純な金属ランタンを取得しました。 (1)
純粋なランタン金属は、1923年にH.クレマーズとR.スティーブンスによる溶融ハロゲン化物の電気分解によって最初に製造されました。
モザンダーはランタナの研究を続け、1841年に発見を発表しました。それに含まれる別の希土類の。彼はそれを「ランタンの不可分の双子の兄弟」であるように思われたので「ジジミウム」と名付けました。(2)
「ジジミウム」は後に別の発見で未知の希土類元素の混合物であることが示されました。 1879年、ボアボードランはジジミウムからサマリウムを検出し、サマリウムを分離しました。カール・アウアー・フォン・ウェルスバッハは1885年に、残りの「ジジミウム」が実際にはネオジムとプラセオジムという2つのまったく新しい元素の混合物であることを発見しました。


ランタンは、餌を与えるリン酸栄養素のレベルを下げるために一部のプール製品で使用されています藻類。

中央上部から時計回りに:プラセオジム、セリウム、ランタン、ネオジム、サマリウム、ガドリニウムの希土類酸化物。写真:LLNL
外観と特徴
有害な影響:
ランタンとその化合物中程度の毒性があると考えられています。
特徴:
ランタンは銀白色の軟質金属で、ナイフで切ることができます。
延性があります。 、可鍛性で露出した表面は空気中で急速に変質して酸化物を形成します。
ランタンは水と反応して、水酸化ランタンと水素ガスを形成します。
ランタンは化学的に反応し、炭素、窒素と化合物を形成します。 、ホウ素、セレン、シリコン、リン、硫黄、およびハロゲン。
ランタンは通常、その化合物に3価のイオンLa3 +として存在します。
ランタンの使用
ランタンは、ハイブリッド自動車用のニッケル水素(NiMH)二次電池に大量に使用されています。 NiMHバッテリーの負極(カソード)は、金属水素化物の混合物であり、その1つは通常水素化ランタンです。陰極の活物質は水素であり、金属水素化物構造に貯蔵されています。金属水素化物は、その組成に応じて、1重量%から7重量%の水素を保持することができます。 (3)トヨタプリウスのバッテリーには約10kgのランタンが必要です。 (4)
ランタンは石油分解触媒として使用され、長鎖炭化水素の短鎖種への分解を触媒します。
ランタンは、ダクタイル鋳鉄を製造するための添加剤として使用され、鋼の添加剤として。
フレームライターフリントは、ランタンを含むミッシュメタル(希土類合金)を使用して、摩擦によって火花を生成します。
ランタンは、水素スポンジ合金に使用されます。大量の水素ガス。
ランタンはナイトビジョンゴーグル(赤外線吸収ガラス)の製造にも使用されます。
高品質のカメラと望遠鏡のレンズには、酸化ランタン(La2O3)が含まれています。その高い屈折率と低い分散。
炭酸ランタンは、腎臓病の患者のリン酸塩の血中濃度を下げるために使用されます。 (5)
ランタン化合物は、藻類が摂食するリン酸塩栄養素のレベルを下げるために、一部のプール製品にも使用されています。
豊富な同位体
豊富な地球の地殻:重量で34 ppm、モルで5ppm
豊富な太陽系:2ppb重量、0.01 ppm
コスト、純粋:100gあたり800ドル
コスト、バルク:100gあたり$
出典:Lanthanumは無料では見つかりません本来は。主に鉱物のモナザイトとバストネサイトに含まれています。商業的には、さまざまな複雑な抽出技術を使用して、モナザイト砂とバストネサイトから回収されます。純粋なランタンは、フッ化物をカルシウム金属で還元することによって得られます。
同位体:ランタンには、半減期がわかっている31の同位体があり、質量数は119〜150です。そのうちの1つは安定しており、139Laです。天然に存在するランタンは、2つの同位体138Laと139Laの混合物であり、天然存在比はそれぞれ0.09%と99.91%です。

このページを引用
オンラインリンクの場合は、次のいずれかをコピーして貼り付けてください:
<a href="https://www.chemicool.com/elements/lanthanum.html">Lanthanum</a>
または
<a href="https://www.chemicool.com/elements/lanthanum.html">Lanthanum Element Facts</a>
学術文書でこのページを引用するには、次のMLA準拠の引用を使用してください:
"Lanthanum." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/lanthanum.html>.