圧力と体積の関係:ボイルの法則
ガスの圧力が高くなると、ガス粒子が互いに接近するため、ガスの体積が減少します。逆に、ガスの圧力が低下すると、ガスの体積が増加します。ガス粒子はさらに離れて移動できるようになりました。ガスの量が増加したため、ウェザーバルーンは大気中を上昇して低圧の領域に移動するにつれて大きくなります。つまり、大気ガスがバルーンの表面に及ぼす圧力は小さくなります。内部ガスは、内圧と外圧が等しくなるまで膨張します。
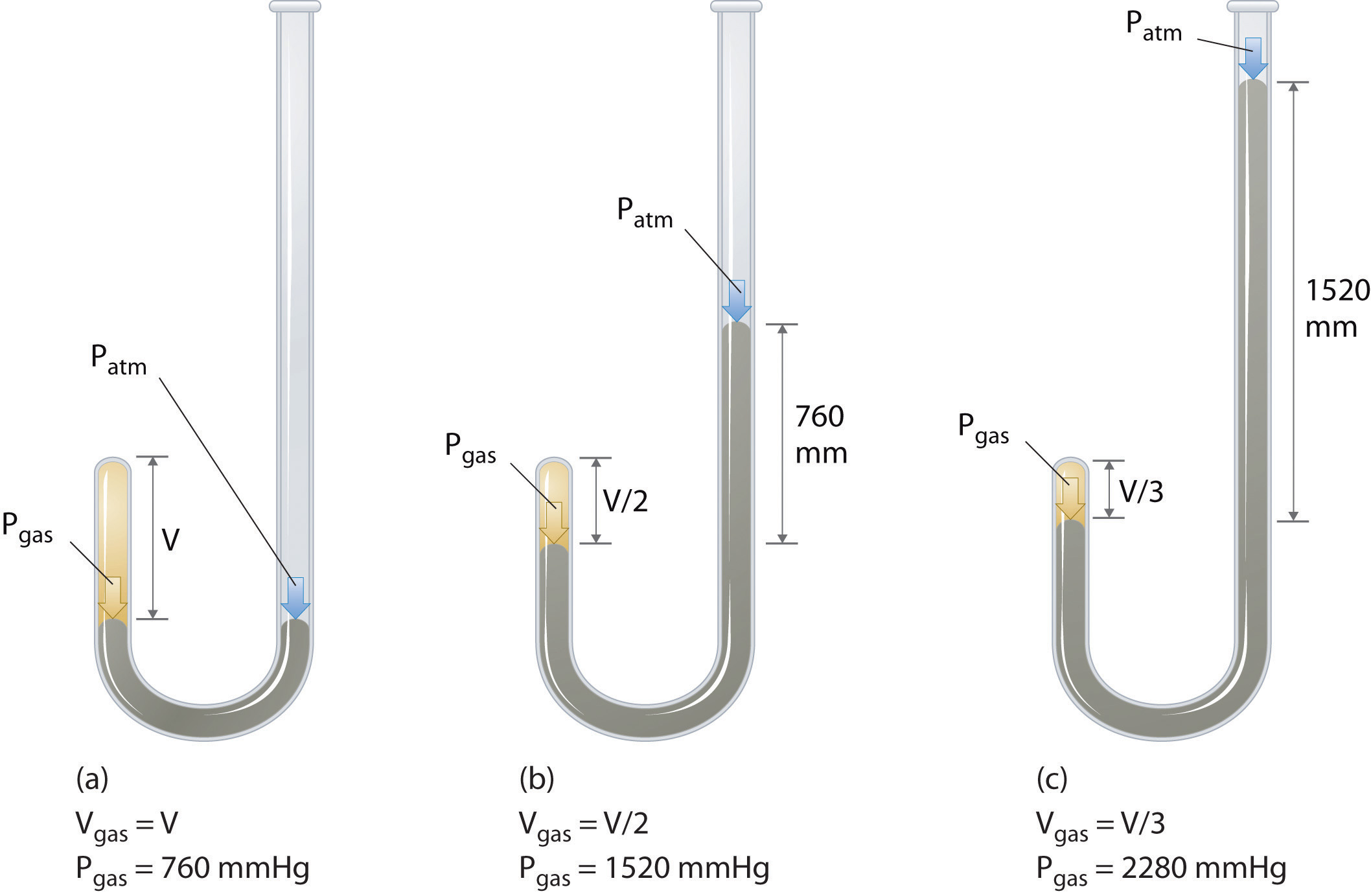
アイルランドの化学者RobertBoyle(1627–1691)は、圧力と体積の量的関係を決定する初期の実験をいくつか実施しました。ガス。ボイルは、図\(\ PageIndex {1} \)に示すように、部分的に水銀で満たされたJ字型のチューブを使用しました。これらの実験では、少量のガスまたは空気が水銀柱の上に閉じ込められ、その体積が大気圧および一定温度で測定されます。次に、より多くの水銀がオープンアームに注がれ、ガスサンプルへの圧力が増加します。ガスの圧力は、大気圧に水銀柱の高さの差を加えたものであり、結果として生じる体積が測定されます。このプロセスは、開いたアームにスペースがなくなるか、ガスの量が少なすぎて正確に測定できないまで繰り返されます。ボイル自身の実験の1つからのデータなどのデータは、いくつかの方法でプロットできます(図\(\ PageIndex {2} \))。 \(V \)対\(P \)の単純なプロットは、双曲線と呼ばれる曲線を示し、圧力と体積の逆の関係を示します。圧力が2倍になると、体積は2分の1に減少します。 2つの量の間のこの関係は、次のように説明されます。
\
両側を\(P \)で割ると、\(P \)と\の間の逆の関係を示す方程式が得られます。 (V \):
\
または
\
ここで、∝記号は「に比例します」と表示されます。したがって、V対1 / Pのプロットは、傾きが式\(\ ref {10.3.1} \)および\(\ ref {10.3.3} \)の定数に等しい直線です。の両側を除算します。 Pの代わりにVを使用した式\(\ ref {10.3.1} \)は、Pと1 / Vの間に同様の関係を与えます。定数の数値は、実験で使用されたガスの量と温度に依存します。実験が行われ、圧力と体積のこの関係は、発見者からボイルの法則として知られており、次のように述べることができます。一定温度では、一定量のガスの体積はその圧力に反比例します。実際の法則を図\(\ PageIndex {2} \)に示します。
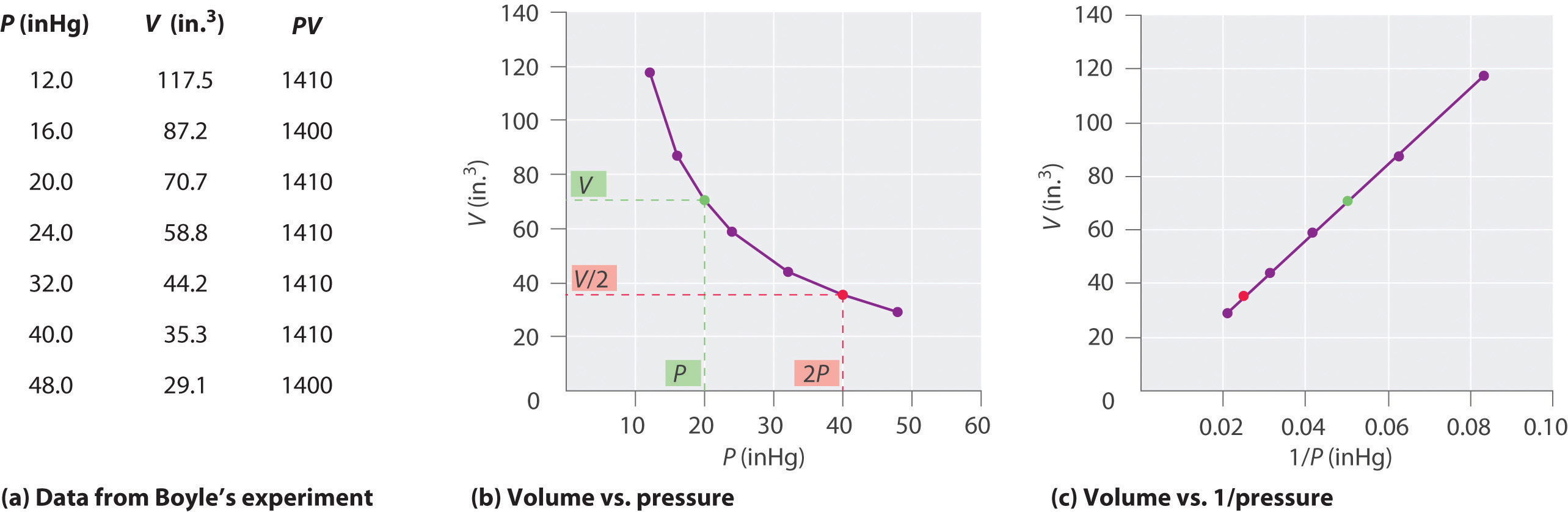
一定の温度では、一定量のガスの体積はその圧力に反比例します