Les preuves empiriques clarifient les facteurs de risque, les causes et les interventions de première intention.
Jeffrey R. Strawn, MD
Clinical professeur de psychiatrie, département de psychiatrie, faculté de médecine de l’Université de Cincinnati
Paul E. Keck Jr, MD
Professeur de psychiatrie, département de psychiatrie, Collège de médecine de l’Université de Cincinnati, président et directeur général, Lindner Center of HOPE, Cincinnati, OH
Stanley N. Caroff, MD
Professeur de psychiatrie, département de psychiatrie, École de médecine de lUniversité de Pennsylvanie, chef de la psychiatrie hospitalière, service de psychiatrie, Philadelphie VA Medical Centre
Le diagnostic et le traitement du syndrome malin des neuroleptiques (SMN) sont controversés car ce syndrome potentiellement mortel est rare et sa présentation varie. Ces facteurs rendent difficile lévaluation des traitements dans les essais cliniques contrôlés, et les données sur lefficacité relative dinterventions spécifiques sont rares. Il est possible, cependant, délaborer des lignes directrices de traitement rationnelles en utilisant des données cliniques empiriques.1,2
Cet article examine les preuves liées à 6 aspects controversés du diagnostic et du traitement du SMN:
• facteurs de risque les plus fiables
• NMS en tant que trouble du spectre
• ce qui cause le NMS
• NMS déclenché par des antipsychotiques de première génération vs de deuxième génération
• interventions de première intention
• redémarrage des antipsychotiques après un épisode de NMS.
EXISTE-T-IL DES FACTEURS DE RISQUE FIABLES POUR LE SMN?
Dans de petites études cas-témoins, lagitation, la déshydratation et lépuisement étaient les facteurs systémiques les plus fréquemment trouvés qui prédisposaient les patients prenant des antipsychotiques au SMN (tableau 1) .3-5 La catatonie et les syndromes cérébraux organiques peuvent être des facteurs de risque distincts.1,6
Des études préliminaires ont également mis en cause des anomalies des récepteurs de la dopamine causées par des polymorphismes génétiques ou des effets dune faible teneur en fer sérique.1,7, 8 Des études pharmacologiques ont suggéré que des doses plus élevées, une titration rapide et Les injections IM dantipsychotiques sont associées à un risque accru de SMN.3,5 Certaines études suggèrent que 15% à 20% des patients NMS ont des antécédents dépisodes de SMN.1,2 En outre, les antipsychotiques de première génération (AGF) de haute puissance – en particulier lhalopéridol – sont supposés présenter un risque plus élevé que les médicaments de faible puissance et les antipsychotiques de deuxième génération (SGA), bien que cette hypothèse reste difficile à prouver.9-11
Ces facteurs de risque ne sont cependant pas pratiques pour estimer le risque de SMN chez un patient donné, car ils sont relativement fréquents par rapport au faible risque de survenue dun SMN. Pour la grande majorité des patients présentant des symptômes psychotiques, les avantages dune pharmacothérapie antipsychotique correctement indiquée lemporteront sur les risques.
Tableau 1 Quest-ce qui augmente le risque de SMN?
- Agitation
- Déshydratation
- Épuisement
- Faibles concentrations sériques de fer (normal: 60 à 170 mcg / dL)
Diagnostics
- Histoire du SMN
- Catatonie
- Syndromes cérébraux organiques
Système nerveux central
- Dysfonctionnement des récepteurs de la dopamine
- Dysfonctionnement des noyaux gris centraux
- Dysfonctionnement du système nerveux sympathique
Traitement pharmacologique *
- Injections intramusculaires ou intraveineuses
- Antagonistes dopaminergiques puissants
- Titration rapide de la dose
- Doses élevées
- FGA par rapport aux SGA (?)
* Pour les patients individuels, ces facteurs de risque communs doivent être pesés à nouveau les avantages de la thérapie antipsychotique
FGA: dabord antipsychotiques de génération;
SGA: antipsychotiques de deuxième génération; NMS: syndrome malin des neuroleptiques
Source: Références 1-5
LE NMS EST-IL LIÉ AU PARKINSONISME, À LA CATATONIE OU À LHYPERTHERMIE MALIGNÉE?
Parkinsonisme. Certains chercheurs ont décrit le SMN comme une crise parkinsonienne extrême résultant dun blocage écrasant des voies de la dopamine dans le cerveau.1,2,12 De ce point de vue, le SMN ressemble au syndrome dhyperthermie parkinsonienne qui peut survenir chez les patients atteints de la maladie de Parkinson après un arrêt brutal ou une perte de efficacité de la thérapie dopaminergique, qui peut être traitée en réinstituant des agents dopaminergiques.13 Les preuves à lappui de ce point de vue comprennent:
• Les signes parkinsoniens sont une caractéristique cardinale du SMN.
• Le sevrage des agonistes dopaminergiques précipite le syndrome.
• Tous les médicaments déclencheurs sont des antagonistes des récepteurs de la dopamine.
• Le risque de SMN est en corrélation avec laffinité des médicaments pour les récepteurs de la dopamine.
• Les agonistes dopaminergiques peuvent être un traitement efficace.
• Les lésions des voies dopaminergiques produisent un syndrome similaire.
• Les patients atteints de SMN ont démontré de faibles concentrations dans le liquide céphalo-rachidien du métabolite dopaminergique acide homovanillique.14
Catatonie. Fink et al15 et autres16-18 ont soutenu de manière convaincante que le NMS représente une forme de catatonie maligne induite par un médicament. Les preuves à lappui comprennent:
• Les 2 troubles partagent des symptômes neuropsychiatriques.
• Les signes catatoniques sont fréquents dans le NMS.19
• La catatonie maligne et le NMS partagent des signes physiologiques et de laboratoire.20
• La réintroduction des antipsychotiques peut aggraver de manière aiguë les deux conditions.
• Benzodiazépines et électroconvulsivothérapie (ECT ) sont des traitements efficaces pour les deux troubles.15-18
Lee21 a examiné la relation entre les caractéristiques catatoniques et la réponse au traitement chez 14 patients NMS. La plupart des patients présentant des symptômes catatoniques ont répondu aux benzodiazépines, alors quaucun de ceux qui présentaient une présentation extrapyramidal-hyperthermique sans catatonie. Lee a conclu que le NMS est hétérogène et peut se présenter sous des formes catatoniques et non catatoniques qui diffèrent dans la réponse au traitement.
Hyperthermie maligne. Certains cliniciens ont comparé le SMN à lhyperthermie maligne causée par les anesthésiques par inhalation et la succinylcholine.1,2 Les preuves comprennent:
• des signes cliniques similaires de rigidité, dhyperthermie et dhypermétabolisme
• des signes physiologiques et biologiques similaires, tels que la rhabdomyolyse
• hyperthermie chez les deux répondeurs au dantrolène.
Bien que les 2 soient de présentation similaire, une hyperthermie maligne survient en peropératoire et reflète un trouble pharmacogénétique de la régulation calcique dans le muscle squelettique. De plus, la rigidité de lhyperthermie maligne ne répond pas aux myorelaxants à action périphérique.1,22 Les données suggèrent que les patients qui ont déjà eu un épisode de SMN ne sont pas à risque dhyperthermie maligne.22
QUELLE EST LA PATHOPHYSIOLOGIE DU NMS?
La physiopathologie du NMS est complexe et implique probablement une interaction entre plusieurs voies centrales et systémiques et des neurotransmetteurs. Comme décrit ci-dessus, des preuves convaincantes suggèrent que le blocage de la dopamine joue un rôle central.12
Le blocage de la dopamine dans lhypothalamus est censé contribuer à léchec de la thermorégulation, et le blocage du système nigrostriatal contribue probablement à la rigidité musculaire et à lhypermétabolisme. La perte dentrée dopaminergique dans le circuit orbitofrontal cingulaire-médial antérieur et le circuit orbitofrontal latéral contribue probablement aux changements détat mental et aux caractéristiques catatoniques observés dans le SMN. 12
Certains chercheurs ont cependant proposé des hypothèses concurrentes ou complémentaires. Par exemple, Gurrera 23 a proposé que les patients qui sont enclins à développer un NMS ont une vulnérabilité à un système nerveux sympathique hyperactif et dérégulé, et ce trait – avec la perturbation du système dopaminergique induite par les agents dopaminergiques – produit NMS. Dautres chercheurs ont mis en cause la sérotonine, la noradrénaline, lacide gamma-aminobutyrique et les mécanismes glutaminergiques. 1,12,24,25
LE FGAS OU SGAS SONT-ILS PLUS SUSCEPTIBLES DE CAUSER UN NMS?
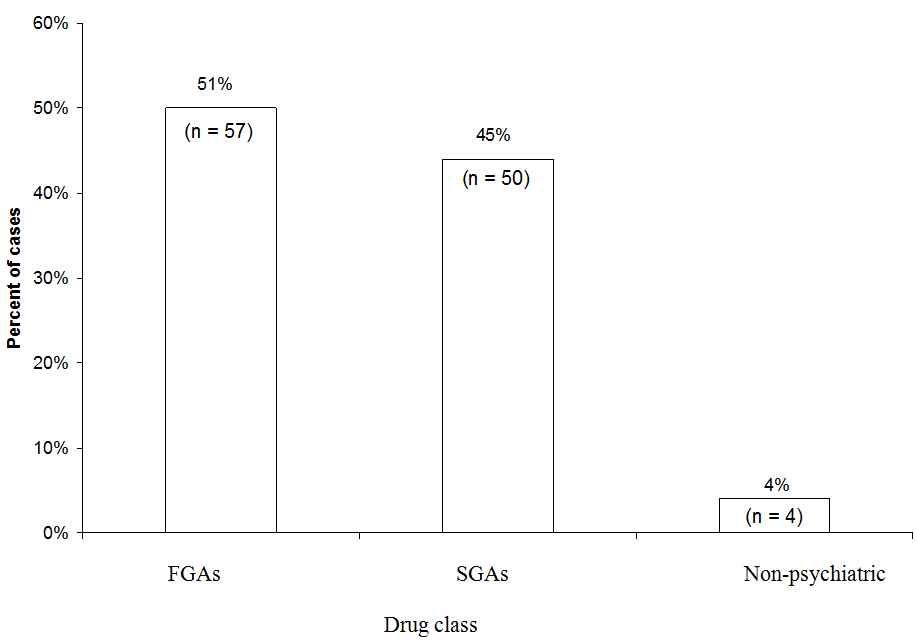
FGA: antipsychotique de première génération
SGA: antipsychotique de deuxième génération
Légèrement plus de cas de NMS ont été attribués aux FGA (51%) quaux SGA (45%) dans une analyse de 111 cas de NMS probables ou définitifs associés à un seul médicament signalés à la hotline du NMS de 1997 à 2006. Lhalopéridol FGA représentait 44% de tous les cas. « Médical » fait référence aux cas dans lesquels un neuroleptique a été utilisé dans un cadre non psychiatrique.
Source: Données non publiées archivées au Service dinformation sur le syndrome neuroleptique malin.
On suppose que le NMS se produit moins fréquemment chez les patients traités par SGA que chez ceux recevant des FGA, bien que cette hypothèse ne soit pas prouvée. Des rapports isolés de NMS ont été associés à presque tous les SGA. difficile de prouver les responsabilités FGA et SGA parce que:
• Le SMN est rare.
• Les pratiques de dosage peuvent être plus conservatrices maintenant que par le passé.
• La plupart des cliniciens sont conscients des premiers signes de NMS.
Dans une étude épidémiologique dune grande base de données, Stubner et al26 ont constaté que les patients recevant des SGA avaient un risque plus faible de NMS que ceux traités avec lhalopéridol.26 Dans cette étude, le taux global de NMS était 0,02%.
Données de la hotline du NMS. Nous avons récemment examiné quelles classes de médicaments étaient impliquées dans 111 cas de NMS signalés au Neuroleptic Malignant S Hotline du service dinformation yndrome (1-888-NMSTEMP) entre 1997 et 2006 (Figure). Nous navons inclus que les cas de SMN définitifs ou probables (tels que diagnostiqués par les consultants de la hotline) dans lesquels un seul antipsychotique a été administré. Un peu plus de cas ont été attribués aux FGA (51%) quaux SGA (45%). Les autres cas ont été attribués à des neuroleptiques utilisés en milieu médical (comme la prométhazine ou la prochlorpérazine).
Comme ils sont maintenant prescrits moins souvent, les AGF représentaient un nombre disproportionné de cas de SMN signalés à la hotline. Lhalopéridol représentait la majorité des cas de FGA et 44% de tous les cas. Si nous avions exclu lhalopéridol et comparé le risque de NMS des SGA à seulement des FGA de puissance intermédiaire ou faible, lavantage relatif des SGA aurait été perdu. Dun autre côté, il est clair que les SGA présentent toujours un risque pour les NMS.
Les analyses suggèrent que les caractéristiques classiques associées aux SGA du SMN – fièvre, rigidité musculaire et changements de statut autonome et mental – sont conservées chez les patients recevant des AGG, même si certains peuvent ne pas développer la rigidité sévère et les températures extrêmes courantes chez les patients recevant des AGG .9-11 Les caractéristiques cliniques plus douces associées aux SGA peuvent refléter des modèles de prescription plus conservateurs ou une sensibilisation accrue et une reconnaissance plus précoce du SMN, ce qui empêcherait les présentations fulminantes.
QUELLES SONT LES PREUVES POUR LES TRAITEMENTS SPÉCIFIQUES DES NEM?
NMS est rare, sa présentation varie et sa progression est imprévisible. Ces facteurs rendent difficile lévaluation des traitements dans le cadre dessais cliniques contrôlés, et les données sur lefficacité relative dinterventions spécifiques sont rares.
Malgré cela, lidée que le NMS représente une variante extrême du parkinsonisme ou de la catatonie dorigine médicamenteuse suggère que le NMS spécifique les traitements peuvent être basés sur la gravité des symptômes ou le stade de présentation. Nous proposons un guide de traitement basé sur des mécanismes théoriques et des données anecdotiques.2,27-29
Support. Après larrêt immédiat du médicament incriminé, la thérapie de soutien est la pierre angulaire du traitement NMS.1,2,27
Pour les patients présentant des signes et symptômes bénins, des soins de soutien et une surveillance clinique attentive peuvent être suffisants. Lhyperthermie extrême nécessite des mesures de réanimation volumique et de refroidissement, des soins médicaux intensifs et une surveillance attentive des complications.
Traitement. Malgré labsence de consensus sur les traitements médicamenteux du SMN non compliqué, environ 40% des patients atteints de SMN aigu reçoivent des traitements pharmacologiques.2
Le lorazépam, 1 à 2 mg par voie parentérale, est un traitement de première intention raisonnable pour le SMN, en particulier chez les personnes atteintes caractéristiques catatoniques. transmission aux symptômes parkinsoniens inversés et il a été rapporté quil réduisait le délai de récupération et de moitié les taux de mortalité lorsquils sont utilisés seuls ou en association avec dautres traitements.13,27,32,33 Larrêt rapide de ces agents peut entraîner des symptômes de rebond, bien que cela puisse être vrai pour tout traitement médicamenteux spécifique du NMS.1,31,32
Le dantrolène dissocie le couplage excitation-contraction en améliorant la séquestration du calcium dans le réticulum sarcoplasmique du muscle squelettique et cest le cas pour nous ed pour traiter les symptômes hypermétaboliques du SMN. Certaines revues ont trouvé une amélioration chez jusquà 80% des patients atteints de SMN traités par monothérapie au dantrolène.27,32-35 Par rapport aux soins de soutien, le temps de récupération peut être réduit – et la mortalité réduite de presque la moitié – lorsque le dantrolène est utilisé seul ou en combinaison avec dautres médicaments.
Tous les rapports de cas nont pas montré que le dantrolène, les benzodiazépines ou les agonistes dopaminergiques sont efficaces dans le traitement du SMN.31,36 À notre avis, seuls les cas avancés de SMN – avec des élévations de température extrêmes, graves rigidité et évidence de lhypermétabolisme systémique – bénéfice du traitement au dantrolène.1,2
ECT a été utilisé avec succès pour réduire la mortalité due au SMN et à dautres troubles du spectre catatonique. Il est généralement utilisé après léchec de la thérapie de soutien et des interventions psychopharmacologiques.2,15,16,27,37 ECT pour le SMN aigu consiste généralement en une série de 6 à 10 traitements avec placement bilatéral délectrodes. Une ECT quotidienne peut être nécessaire au départ.15
LES ANTIPSYCHOTIQUES SONT-ILS CONTRE-INDIQUÉS À LA SUITE DUN ÉPISODE NMS?
Le taux de récidive du NMS lors dun retraitement avec un antipsychotique a varié.38 Nous estimons que jusquà 30 % des patients peuvent présenter un risque de récidive du SMN lorsquils sont réengagés avec un antipsychotique.1 Cependant, en suivant les précautions appropriées (tableau 2), vous pouvez traiter en toute sécurité la plupart des patients qui nécessitent un traitement antipsychotique continu.1,2
Lorsque vous recommencez le traitement , un antipsychotique de moindre puissance dune classe chimique différente peut être une option plus sûre que de réessayer lagent déclencheur, selon des analyses rétrospectives des données disponibles limitées. Un patient qui développe un SMN sur un FGA pourrait bénéficier dun essai SGA, bien quun certain risque de récidive demeure.1,10
Tableau 2Réintroduction dantipsychotiques après un épisode NMS
Revérifier lexactitude du diagnostic dun épisode NMS précédent
Document indications pour les médicaments antipsychotiques
Discutez des risques et des avantages, y compris le risque de récidive, avec le patient et sa famille
Envisagez dautres agents pharmacologiques
Minimiser les facteurs de risque (Tableau 1)
Attendre ≥2 semaines (≥4 semaines pour les médicaments injectables à action prolongée) après la résolution dun épisode de SMN avant de reprendre le contrôle
Sélectionnez des FGA ou des SGA de faible puissance
Prescrire une dose dessai initiale
Surveiller les signes vitaux et létat neurologique
Titrer doses progressivement
FGA: antipsychotiques de première génération;
SGA: antipsychotiques de deuxième génération
Source: Références 1,2
Ressources connexes
• Service dinformation sur le syndrome malin des neuroleptiques. www.nmsis.org.
• Zarrouf FA, Bhanot V. Syndrome malin des neuroleptiques: ne baissez pas la garde. Psychiatrie actuelle 2007; 6 (8): 89-95.
Noms de marque des médicaments
Amantadine • Symmetrel
Bromocriptine • Parlodel
Chlorpromazine • Thorazine
Dantrolène • Dantrium®
Fluphénazine • Prolixine
Halopéridol • Haldol
Lorazépam • Ativan
Loxapine • Loxitane
Perphénazine • Trilafon
Prochlorpérazine • Compazine, Compro
Prométhazine • Phenergan
Thioridazine • Mellaril
Divulgation
Dr. Strawn est un chercheur de lInstitut psychiatrique américain pour la recherche et léducation (APIRE) / Janssen.
Dr. Keck a reçu un soutien de recherche ou a été consultant pour Abbott Laboratories, American Diabetes Association, AstraZeneca Pharmaceuticals, Bristol-Myers Squibb, GlaxoSmithKline, Eli Lilly and Company, Janssen Pharmaceutica, National Institute of Mental Health, National Institute of Drug Abuse, Pfizer , Stanley Medical Research Institute et UCB Pharma.
Dr. Caroff a reçu le soutien de recherche de Bristol-Myers Squibb, Ortho-McNeil Neurologics et Pfizer.
- Caroff SN. Syndrome malin des neuroleptiques, dans: Mann SC, Caroff SN, Keck PE Jr, Lazarus A, eds. Syndrome malin des neuroleptiques et affections apparentées 2e éd. Washington, DC: American Psychiatric Publishing Inc; 2003; 1-44.
- Strawn JR, Keck PE Jr, Caroff SN. Syndrome malin des neuroleptiques Am J Psychiatry 2007; 164: 870–6.
- Keck PE Jr, Pope HG Jr, Cohen BM, et al. Facteurs de risque du syndrome malin des neuroleptiques Arch Gen Psychiatry 1989; 46: 914–18.
- Rosebush PI, Stewart TD. Une analyse prospective de 24 épisodes de syndrome malin des neuroleptiques Am J Psychiatry 1989; 146: 717–25.
- Berardi D, Amore M, Keck PE Jr, et al. Facteurs de risque cliniques et pharmacologiques du syndrome malin des neuroleptiques: une étude cas-témoins. Biol Psychiatry 1998; 44: 748–54.
- White DA, Robins AH. Catatonie: signe avant-coureur du syndrome malin des neuroleptiques Br J Psychiatry 1991; 158: 419–21.
- Rosebush PI, Mazurek MF. Fer sérique et syndrome malin des neuroleptiques. Lancet 1991; 338: 149–51.
- Lee JW. Fer sérique dans la catatonie et le syndrome malin des neuroleptiques Biol Psychiatry 1998; 44: 499–507.
- Ananth J, Parameswaran S, Gunatilake S, et al. Syndrome malin des neuroleptiques et médicaments antipsychotiques atypiques J Clin Psychiatry 2004; 65: 464–70.
- Caroff SN, Mann SC, Campbell EC. Antipsychotiques atypiques et syndrome malin des neuroleptiques Psychiatr Ann 2000; 30: 314–21.
- Hasan S, Buckley P. Novel antipsychotics and the neuroleptic malin syndrome Am J Psychiatry 1998; 155: 1113–16.
- Mann SC, Caroff SN, Fricchione G, Campbell EC. Hypoactivité dopaminergique centrale et pathogenèse du syndrome malin des neuroleptiques Psychiatr Ann 2000; 30: 363–74.
- Factor SA, Santiago A. Parkinsonism-hyperpyrexia syndrome in Parkinsons disease. In: Frucht SJ, Fahn S, eds . Urgences liées aux troubles du mouvement: diagnostic et traitement. Totowa, NJ: Humana Press; 2005; 29-40.
- Nisijima K, Ishiguro T. Niveaux de liquide céphalo-rachidien de métabolites monoamine et dacide gamma-aminobutyrique dans le syndrome malin des neuroleptiques. J Psychiatr Res 1995; 27: 233–44.
- Fink M, Taylor MA. Le syndrome malin des neuroleptiques est une catatonie maligne, justifiant des traitements efficaces contre la catatonie. Prog Neuropsychopharmacol Biol Psychiatry 2006; 30: 1182–3.
- Fricchione G, Bush G, Fozdar M, et al. Reconnaissance et traitement du syndrome catatonique. J Intensive Care Med 1997; 12: 135–47.
- Philbrick KL, Rummans TA. Catatonie maligne. J Neuropsychiatry Clin Neurosci 1994; 6: 1–13.
- Mann SC, Caroff SN, Bleier HR, et al. Catatonie mortelle. Am J Psychiatry 1986; 143: 1374–81.
- Koch M, Chandragiri S, Rizvi S, et al. Signes catatoniques dans le syndrome malin des neuroleptiques. Compr Psychiatry 2000; 41: 73–5.
- Lee JW. Résultats de laboratoire. Dans: Caroff SN, Mann SC, Francis A, Fricchoine GL, eds. Catatonie: de la psychopathologie à la neurobiologie Washington, DC: American Psychiatric Press, Inc; 2004; 65-75.
- Lee JW.Variantes catatoniques, réactions extrapyramidales hyperthermiques et sous-types de syndrome malin des neuroleptiques. Ann Clin Psychiatry 2007; 19: 9–16.
- Caroff SN, Rosenberg H, Mann SC, et al. Syndrome malin des neuroleptiques en situation périopératoire. Am J Anesthesiol 2001; 28: 387–93.
- Gurrera RJ. Hyperactivité sympatho-surrénalienne et étiologie du syndrome malin des neuroleptiques. Am J Psychiatry 1999; 156: 169–80.
- Carroll BT. Lhypothèse de champ universel de la catatonie et du syndrome malin des neuroleptiques. CNS Spectr 2000; 5: 26–33.
- Weller M, Kornhuber J. Une justification de la thérapie antagoniste des récepteurs NMDA du syndrome malin des neuroleptiques. Med Hypotheses 1992; 38: 329–33.
- Stubner S, Rustenbeck E, Grohmann R, et al. Troubles du mouvement involontaires graves et rares dus aux médicaments psychotropes. Pharmacopsychiatry 2004; 37 (suppl. 1): S54 – S64.
- Davis JM, Caroff SN, Mann SC. Traitement du syndrome malin des neuroleptiques. Psychiatr Ann 2000; 30: 325–31.
- Adityanjee PA, Singh S, Singh G, Ong S. Spectrum concept du syndrome malin des neuroleptiques. Br J Psychiatry 1988; 153: 107–11.
- Woodbury MM, Woodbury MA. Catatonie induite par les neuroleptiques comme étape de la progression vers le syndrome malin des neuroleptiques. J Am Acad Child Adolesc Psychiatry 1992; 31: 1161–4.
- Francis A, Chondragivi S, Rizvi S, et al. Le lorazépam est-il un traitement du syndrome malin des neuroleptiques? CNS Spectr 2000; 5: 54–7.
- Rosebush PI, Stewart T, Mazurek MF. Le traitement du syndrome malin des neuroleptiques. Le dantrolène et la bromocriptine sont-ils des compléments utiles aux soins de soutien? Br J Psychiatry 1991; 159: 709–12.
- Sakkas P, Davis JM, Janicak PG, Wang ZY. Traitement médicamenteux du syndrome malin des neuroleptiques. Psychopharmacol Bull 1991; 27: 381–4.
- Rosenberg MR, Green M. Syndrome malin neuroleptique: examen de la réponse au traitement. Arch Intern Med 1989; 149: 1927–31.
- Yamawaki S, Morio M, Kazamutsuri G, et al. Évaluation clinique et utilisation efficace du dantrolène sodique dans le syndrome malin des neuroleptiques. Kiso à Rinsyou (rapports cliniques) 1993; 27: 1045–66.
- Tsutsumi Y, Yamamoto K, Matsuura S, et al. Le traitement du syndrome malin des neuroleptiques à laide de dantrolène sodique. Psychiatry Clin Neurosci 1998; 52: 433–8.
- Reulbach U, Dutsch C, Biermann T, et al. Gérer un traitement efficace du syndrome malin des neuroleptiques. Crit Care 2007; 11: R4.
- Troller JN, Sachdev PS. Traitement électroconvulsif du syndrome malin des neuroleptiques: examen et rapport de cas. Aust N Z J Psychiatry 1999; 33: 650–9.
- Pope HG, Aizley HG, Keck PE Jr, McElroy SL. Syndrome malin des neuroleptiques: suivi à long terme de 20 cas. J Clin Psychiatry 1991; 52: 208–12.