Lélément chimique lanthane est classé comme lanthanide et terre rare. Il a été découvert en 1839 par Carl G. Mosander.

Zone de données
| Classification: | Le lanthane est un lanthanide et un métal des terres rares |
| Couleur: | blanc argenté |
| Atomique poids: | 138.9055 |
| État: | solide |
| Point de fusion : | 1540 oC, 1813,2 K |
| Point débullition: | 2830 oC, 3103 K |
| Électrons: | 57 |
| Protons: | 57 |
| Neutrons dans lisotope le plus abondant: | 82 |
| Coquilles délectrons: | 2,8,18,18, 9,2 |
| Configuration électronique: | 5d1 6s2 |
| Densité à 20oC: | 6,16 g / cm3 |
Afficher plus, y compris: Chaleur, Energies, Oxydation,
Réactions , Composés, Rayons, Conductivités
| Volume atomique: | 22,5 cm3 / mol |
| Structure: | hcp: hexagonal serré |
| Dureté: | 2,5 mohs |
| Capacité thermique spécifique | 0,19 J g-1 K-1 |
| Chaleur de fusion | 6.20 kJ mol-1 |
| Chaleur datomisation | 414 kJ mol-1 |
| Chaleur de vaporisation | 400 kJ mol-1 |
| 1ère énergie dionisation | 538,1 kJ mol-1 |
| 2ème énergie dionisation | 1067 kJ mol-1 |
| 3ème énergie dionisation | 1850 kJ mol-1 |
| Affinité électronique | 50 kJ mol-1 |
| Nombre minimal doxydation | 0 |
| Min. n ° doxydation commun. | 0 |
| Indice doxydation maximal | 3 |
| Max. oxydation commune no. | 3 |
| Électronégativité (échelle de Pauling) | 1.1 |
| Polarisabilité volume | 31,1 Å3 |
| Réaction avec lair | vigoureux, w / ht ⇒ La2O3 |
| Réaction avec 15 M HNO3 | légère, ⇒ La (NO3) 3 |
| Réaction avec 6 M HCl | doux, ⇒ H2, LaCl3 |
| Réaction avec 6 M NaOH | aucun |
| Oxyde ( s) | La2O3 |
| Hydrure (s) | LaH2, LaH3 |
| Chlorure (s) | LaCl3 |
| Rayon atomique | 195 pm |
| Rayon ionique (1+ ion) | – |
| Rayon ionique (2+ ion) | – |
| Rayon ionique (3+ ion) | 117,2 pm |
| Rayon ionique (1 ion) | – |
| Rayon ionique (2-ion) | – |
| ionique rayon (3 ions) | – |
| Conductivité thermique | 13,4 W m-1 K-1 |
| Conductivité électrique | 1,9 x 106 S m-1 |
| Point de congélation / fusion: | 1540 oC, 1813,2 K |

Le lanthane est utilisé dans de nombreuses applications, telles que léclairage de studio, batteries dordinateurs portables, objectifs dappareils photo et batteries de voitures hybrides.
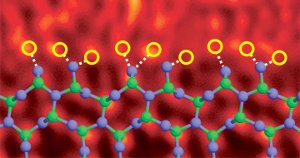
Bordure de grain de nitrure de silicium dopée avec des atomes de lanthane. Image Réf. (6)
Découverte du Lanthane
Le lanthane a été découvert en 1839 par Carl G. Mosander dans la cérite minérale de Stockholm, en Suède.
Ceria (oxyde de cérium) avait déjà été découvert en 1803 par le chimiste suédois Jacob Berzelius dans la cérite minérale. Mosander, qui avait été l’un des étudiants de Berzelius, soupçonnait que la céria était un oxyde impur contenant d’autres terres rares. (1)
Mosander a pris du nitrate de cérium en poudre fine et a ajouté de lacide nitrique dilué à froid. Une partie de la poudre de nitrate de cérium dissoute dans lacide indiquant une nouvelle terre pourrait être présente. Le nouvel oxyde était plus basique que la cérium (oxyde de cérium) et, contrairement à la cérium, dissous dans lacide.
Mosander a séparé la solution du précipité en utilisant de loxalate de sodium et de la chaleur. Il a obtenu un oxyde de couleur brique pâle de la nouvelle terre rare. (1)
Le nom lanthana pour le nouvel oxyde a été suggéré par son ami Berzelius.
Le nom vient du mot grec «lanthano» qui signifie être caché.
Axel Erdmann a découvert le lanthane indépendamment la même année que Mosander dans un minéral norvégien nouvellement découvert. Erdmann a appelé la nouvelle mosandrite minérale, en lhonneur de Mosander.(2)
Mosander a obtenu du lanthane métallique impur à partir du chlorure. (1)
Le métal de lanthane pur a été produit pour la première fois en 1923 par électrolyse des halogénures fondus par H. Kremers et R. Stevens.
Mosander a continué à étudier la lanthana et en 1841 a annoncé la découverte dune autre terre rare quil contient. Il la nommé «didyme» parce quil semblait être «un frère jumeau inséparable du lanthane». (2)
«Didymium» a été plus tard montré dans des découvertes séparées comme étant un mélange déléments de terres rares inconnus. En 1879, Lecoq de Boisbaudran détecta du samarium dans du didyme et en sépara le samarium. Carl Auer von Welsbach a découvert en 1885 que le «didyme» restant était en fait un mélange de deux éléments entièrement nouveaux: le néodyme et le praséodyme.


Le lanthane est utilisé dans certains produits de piscine pour réduire le niveau de phosphates nutritifs qui se nourrissent des algues.

Dans le sens des aiguilles dune montre à partir du centre supérieur: oxydes de terres rares de praséodyme, cérium, lanthane, néodyme, samarium et gadolinium. Photo: LLNL
Apparence et caractéristiques
Effets nocifs:
Lanthane et ses composés sont considérés comme modérément toxiques.
Caractéristiques:
Le lanthane est un métal mou blanc argenté, qui peut être coupé avec un couteau.
Il est ductile , les surfaces malléables et exposées se ternissent rapidement dans lair formant loxyde.
Le lanthane réagit avec leau pour former de lhydroxyde de lanthane plus de lhydrogène gazeux.
Le lanthane est chimiquement réactif et forme des composés avec le carbone, lazote , bore, sélénium, silicium, phosphore, soufre et avec les halogènes.
Le lanthane existe généralement sous forme dion trivalent, La3 +, dans ses composés.
Utilisations du lanthane
Le lanthane est utilisé en grande quantité dans les batteries rechargeables à hydrure métallique de nickel (NiMH) pour les automobiles hybrides. Lélectrode négative (cathode) des batteries NiMH est un mélange dhydrures métalliques – dont lun est généralement lhydrure de lanthane. Le matériau actif à la cathode est lhydrogène, qui est stocké dans la structure dhydrure métallique. Lhydrure métallique peut, selon sa composition, contenir entre 1% et 7% en poids dhydrogène. (3) Une batterie Toyota Prius nécessite environ 10 kg de lanthane. (4)
Le lanthane est utilisé comme catalyseur de craquage du pétrole, catalysant la division des hydrocarbures à longue chaîne en espèces à chaîne plus courte.
Le lanthane est utilisé comme additif pour fabriquer de la fonte nodulaire et comme additif dans lacier.
Les silex plus légers utilisent du métal misch (un alliage de terres rares) contenant du lanthane pour produire des étincelles par friction.
Le lanthane est utilisé dans les alliages déponge dhydrogène, qui prennent jusquà 400 fois le leur. volume dhydrogène gazeux.
Le lanthane est également utilisé pour fabriquer des lunettes de vision nocturne (verre absorbant les infrarouges).
Les lentilles des caméras et des télescopes de haute qualité contiennent de loxyde de lanthane (La2O3) utilisant son indice de réfraction élevé et sa faible dispersion.
Le carbonate de lanthane est utilisé pour réduire les taux sanguins de phosphate chez les patients atteints de maladie rénale. (5)
Les composés de lanthane sont également utilisés dans certains produits de piscine pour réduire le niveau de phosphates nutritifs dont les algues se nourrissent.
Abondance et isotopes
Abondance de la croûte terrestre: 34 parties par million en poids, 5 parties par million en moles
Système solaire dabondance: 2 parties par milliard par poids, 0,01 partie par milliard en moles
Coût, pur: 800 $ par 100g
Coût, en vrac: $ par 100g
Source: Le lanthane nest pas trouvé gratuitement dans la nature. On le trouve principalement dans les minéraux monazite et bastnaesite. Commercialement, il est récupéré à partir de sable monazite et de bastnaesite à laide de diverses techniques dextraction complexes. Le lanthane pur est obtenu par réduction du fluorure avec du calcium métal.
Isotopes: Le lanthane a 31 isotopes dont la demi-vie est connue, avec des nombres de masse de 119 à 150. Parmi ceux-ci, lun est stable, 139La. Le lanthane dorigine naturelle est un mélange des deux isotopes 138La et 139La avec des abondances naturelles de 0,09% et 99,91% respectivement.

Citez cette page
Pour créer des liens en ligne, veuillez copier et coller lun des éléments suivants:
<a href="https://www.chemicool.com/elements/lanthanum.html">Lanthanum</a>
ou
<a href="https://www.chemicool.com/elements/lanthanum.html">Lanthanum Element Facts</a>
Pour citer cette page dans un document académique, veuillez utiliser la citation suivante conforme MLA:
"Lanthanum." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/lanthanum.html>.