Le terme conduction aberrante fait référence à un bloc de branche transitoire non dû à des anomalies antérieures du QRS, à la conduction de la voie accessoire ou aux effets indésirables des médicaments. 1 Le blocage peut survenir à nimporte quel niveau du système His-Purkinje et peut être dû à différents mécanismes. Le bloc de phase 3 (dépendant de la tachycardie) est dû à une invasion de tissu pendant la période réfractaire effective et peut être un phénomène physiologique ou pathologique. Une forme spéciale de ce bloc est le bloc dépendant de laccélération, qui est dû aux changements de la fréquence cardiaque. Le bloc de phase 4 (dépendant de la bradycardie ou de la pause) est presque toujours pathologique. Elle survient après la fin de la période réfractaire en raison dune diminution du potentiel membranaire, en raison dune augmentation de lautomaticité dHis-Purkinje ou dune dépolarisation partielle de la lésion myocardique. Le quatrième et dernier mécanisme aberrant est dû à la conduction cachée, qui est définie comme la propagation dune impulsion dans le système de conduction spécifique et ne peut être reconnue que par son effet sur limpulsion, lintervalle ou les cycles suivants.2 Comme indiqué par son nom, ce phénomène ne peut être observé à lélectrocardiogramme de surface (ECG).
Nous présentons le cas dune femme de 86 ans admise aux urgences pour palpitations et dyspnée. Quelques années auparavant, elle avait été évaluée par un cardiologue pour une bradycardie sinusale asymptomatique, pour laquelle elle ne recevait pas de traitement. Lexamen physique a révélé des bruits cardiaques irréguliers de faible intensité sans souffles et crépitements bibasaux sans autres résultats intéressants. À ladmission, lECG a montré une fibrillation auriculaire avec une réponse ventriculaire denviron 100 bpm, avec bloc fasciculaire antérieur gauche (LAFB), alternant avec des battements avec un complexe QRS plus étroit (Figure 1A et Figure dans le matériel supplémentaire). Pendant son séjour au service des urgences, la patiente a reçu 2,5 mg daténolol par voie intraveineuse et atteint un rythme sinusal à un taux de 39 bpm, avec normalisation de la morphologie QRS (Figure 1B et Figure dans le matériel supplémentaire). Le patient est sorti sans traitement antiarythmique. À 3 semaines, elle a été admise avec une asthénie marquée et une bradycardie sinusale documentée à 35 bpm, pour laquelle elle a reçu un stimulateur cardiaque DDD.
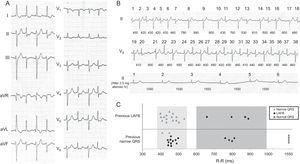
A: électrocardiographe à 12 dérivations. B: traçage ECG complet à ladmission. Les temps 1 à 38 sont consécutifs bien quils soient dans 2 fils différents (II et V5). Les durées de cycle entre les battements sont indiquées en millisecondes. Le panneau inférieur montre la morphologie QRS après administration intraveineuse de 2,5 mg daténolol et conversion en rythme sinusal. C: La relation de la morphologie QRS avec la longueur du cycle et la morphologie du battement précédent. LAFB, bloc fasciculaire antérieur gauche.
Une analyse minutieuse de lECG obtenu au cours de lépisode a clairement montré 2 types de QRS: a) QRS avec morphologie LAFB (120ms), en alternance avec b) QRS étroit avec petit variations daxe et de durée (90–100ms). De plus, à des intervalles R – R plus longs, les battements avaient toujours une morphologie LAFB. Deux zones peuvent être clairement différenciées sur la figure 1C, qui compare la morphologie du QRS avec la longueur du cycle et le complexe QRS précédent.3 Dans la zone 1 (R – R, 400-530 ms), la morphologie du QRS dépend du battement précédent , (cest-à-dire que si le battement précédent est étroit, le battement suivant aura une morphologie LAFB). Les seules exceptions à cette règle sont les battements 32–33, qui pourraient sexpliquer par la pénétration de limpulsion dans la phase de conduction supra normale du fascicule antérieur.3,4 Cependant, dans la zone 2 (R – R > 600ms), le complexe QRS a toujours une morphologie LAFB indépendamment de la morphologie du battement précédent, ce qui évoque un bloc dépendant de la bradycardie. Laspect curieux de ce cas est que, contrairement à ce que lon attendrait dans ce type de bloc, après un intervalle RR beaucoup plus long (> 1500ms), le QRS devient normal.
La figure 2 montre le mécanisme proposé pour ces résultats. Avec des intervalles R – R courts (zone 1), un bloc antérograde et rétrograde se produit dans le fascicule antérieur, ce qui rend limpulsion suivante capable de conduire antérograde car elle a le temps de se repolariser. De cette manière, les petites variations des complexes QRS étroits pourraient sexpliquer par leur apparition à différents moments de leur période réfractaire relative, avec un degré de latence plus ou moins élevé (par exemple, battements 3 et 7, ou 13 et 15). Avec des cycles très longs, la récupération des tissus et la conduction antérograde permanente ont lieu. Cohen et al5 ont décrit ce phénomène à la fin des années 1970 et lont appelé alternance de bloc de branche dépendant de la pseudobradycardie (cest-à-dire un bloc de phase 3).Pour cela, la période réfractaire efficace rétrograde du fascicule antérieur doit être inférieure à la période réfractaire effective antérograde et donc favoriser la conduction rétrograde cachée.4
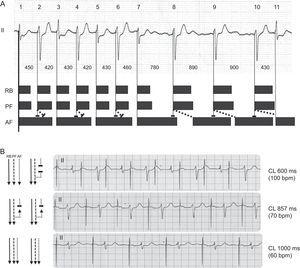
A. Mécanisme proposé des résultats électrocardiographiques. Les barres noires représentent les périodes réfractaires effectives théoriques et les lignes pointillées obliques représentent la conduction interfasciculaire rétrograde cachée. B. Confirmation du mécanisme par stimulation auriculaire (AAI). FA, fascicule antérieur; CL, durée du cycle; PF, fascicule postérieur; RB, branche droite.
Nous avons pu confirmer ce mécanisme (Figure 2B) car notre patient avait été implanté avec un stimulateur cardiaque DDD. Le LAFB alterné a été produit par stimulation AAI à 100 bpm, à 70 bpm tous les battements ont été conduits avec la morphologie LAFB, et à 60 bpm tous les battements étaient étroits, ce qui a confirmé un blocage dépendant de la tachycardie.