La relation entre pression et volume: Loi de Boyle
À mesure que la pression sur un gaz augmente, le volume du gaz diminue car les particules de gaz sont forcées de se rapprocher. Inversement, lorsque la pression sur un gaz diminue, le volume de gaz augmente parce que le les particules de gaz peuvent maintenant séloigner les unes des autres. Les ballons météorologiques deviennent plus gros lorsquils montent dans latmosphère vers des régions de pression plus basse parce que le volume du gaz a augmenté; autrement dit, le gaz atmosphérique exerce moins de pression à la surface du ballon, de sorte que le le gaz intérieur se dilate jusquà ce que les pressions interne et externe soient égales.
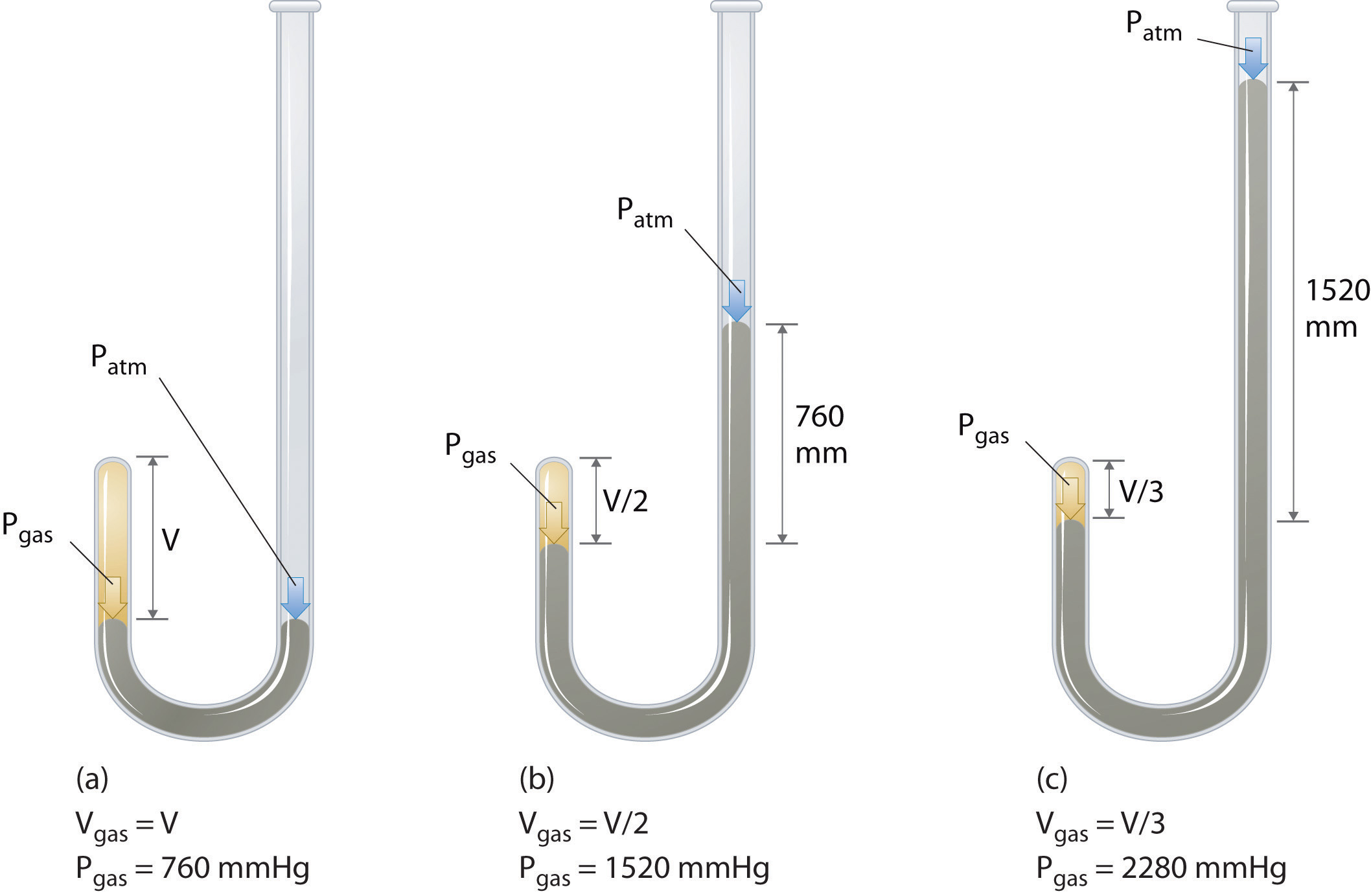
Le chimiste irlandais Robert Boyle (1627-1691) a réalisé certaines des premières expériences qui ont déterminé la relation quantitative entre la pression et le volume de un gaz. Boyle a utilisé un tube en forme de J partiellement rempli de mercure, comme le montre la figure \ (\ PageIndex {1} \). Dans ces expériences, une petite quantité dun gaz ou dair est piégée au-dessus de la colonne de mercure, et son volume est mesuré à pression atmosphérique et à température constante. Plus de mercure est ensuite versé dans le bras ouvert pour augmenter la pression sur léchantillon de gaz. La pression sur le gaz est la pression atmosphérique plus la différence des hauteurs des colonnes de mercure, et le volume résultant est mesuré. Ce processus est répété jusquà ce quil ny ait plus de place dans le bras ouvert ou que le volume de gaz soit trop petit pour être mesuré avec précision. Des données telles que celles de lune des propres expériences de Boyle peuvent être tracées de plusieurs manières (Figure \ (\ PageIndex {2} \)). Un simple graphique de \ (V \) en fonction de \ (P \) donne une courbe appelée hyperbole et révèle une relation inverse entre la pression et le volume: lorsque la pression est doublée, le volume diminue dun facteur deux. Cette relation entre les deux quantités est décrite comme suit:
\
En divisant les deux côtés par \ (P \), on obtient une équation illustrant la relation inverse entre \ (P \) et \ (V \):
\
ou
\
où le symbole ∝ est lu « est proportionnel à ». Un tracé de V en fonction de 1 / P est donc une ligne droite dont la pente est égale à la constante des équations \ (\ ref {10.3.1} \) et \ (\ ref {10.3.3} \). Diviser les deux côtés de Léquation \ (\ ref {10.3.1} \) par V au lieu de P donne une relation similaire entre P et 1 / V. La valeur numérique de la constante dépend de la quantité de gaz utilisée dans lexpérience et de la température à laquelle Cette relation entre la pression et le volume est connue sous le nom de loi de Boyle, daprès son découvreur, et peut être énoncée comme suit: À température constante, le volume dune quantité fixe dun gaz est inversement proportionnel à sa pression. la loi dans la pratique est illustrée à la figure \ (\ PageIndex {2} \).
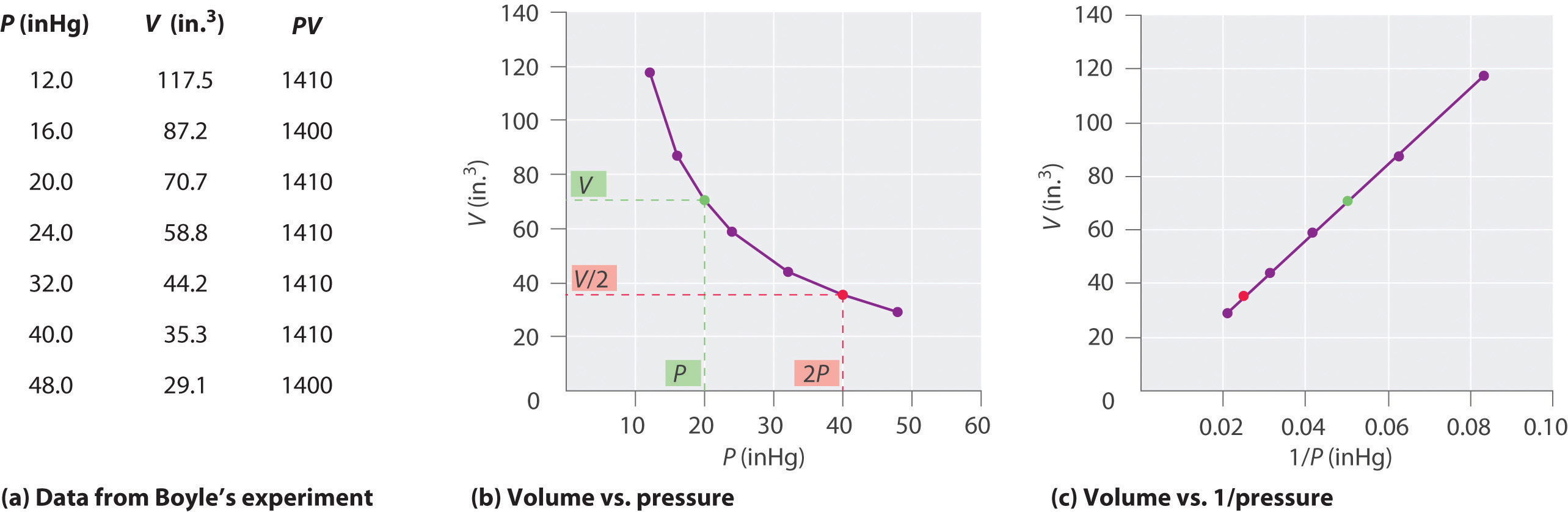
À température constante, le volume dune quantité fixe dun gaz est inversement proportionnel à sa pression